|
|
МЕНЮ
|
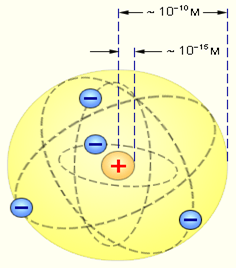
Реферат: Открытие атомаТаким образом, опыты Резерфорда и его сотрудников привели к выводу, что в центре атома находится плотное положительно заряженное ядро, диаметр которого не превышает 10–14–10–15 м. Это ядро занимает только 10–12 часть полного объема атома, но содержит весь положительный заряд и не менее 99,95 % его массы. Веществу, составляющему ядро атома, следовало приписать колоссальную плотность порядка ρ ≈ 1015 г/см3. Заряд ядра должен быть равен суммарному заряду всех электронов, входящих в состав атома. Впоследствии удалось установить, что если заряд электрона принять за единицу, то заряд ядра в точности равен номеру данного элемента в таблице Менделеева. Радикальные выводы о строении атома, следовавшие из опытов Резерфорда, заставляли многих ученых сомневаться в их справедливости. Не исключением был и сам Резерфорд, опубликовавший результаты своих исследований только через два года (в 1911 г.) после выполнения первых экспериментов. Опираясь на классические представления о движении микрочастиц, Резерфорд предложил планетарную модель атома. Согласно этой модели, в центре атома располагается положительно заряженное ядро, в котором сосредоточена почти вся масса атома. Атом в целом нейтрален. Вокруг ядра, подобно планетам, вращаются под действием кулоновских сил со стороны ядра электроны (рис. 4). Находиться в состоянии покоя электроны не могут, так как они упали бы на ядро.
Планетарная модель атома Резерфорда. Показаны круговые орбиты четырех электронов Планетарная модель атома, предложенная Резерфордом, несомненно, явилась крупным шагом в развитии знаний о строении атома. Она была совершенно необходимой для объяснения опытов по рассеянию α-частиц. Однако она оказалась неспособной объяснить сам факт длительного существования атома, т. е. его устойчивость. По законам классической электродинамики, движущийся с ускорением заряд должен излучать электромагнитные волны, уносящие энергию. За короткое время (порядка 10–8 с) все электроны в атоме Резерфорда должны растратить всю свою энергию и упасть на ядро. То, что этого не происходит в устойчивых состояниях атома, показывает, что внутренние процессы в атоме не подчиняются классическим законам. 7 марта 1911 года Резерфорд сделал в философском обществе в Манчестере доклад "Рассеяние a и b-лучей и строение атома". В докладе он, в частности, говорил: "Рассеяние заряженных частиц может быть объяснено, если предположить такой атом, который состоит из центрального электрического заряда, сосредоточенного в точке и окруженного однородным сферическим распределением противоположного электричества равной величины. При таком устройстве α и b-частицы, когда они проходят на близком расстоянии от центра атома, испытывают большие отклонения, хотя вероятность такого отклонения мала". Таким образом,
изучение рассеяния α- частиц положило начало развитию именно ядерной
теории атома, так как планетарная модель Резерфорда оказалась несостоятельной.
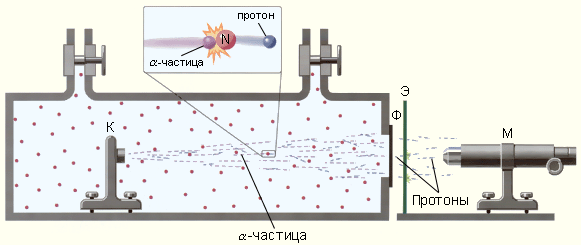
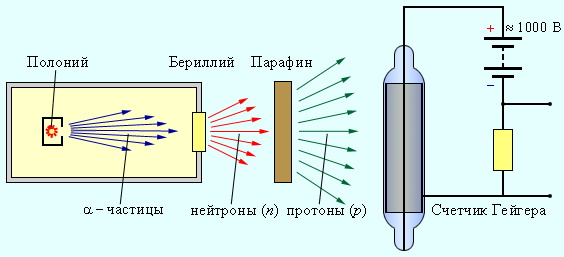
Прибор Резерфорда состоял из вакуумированной камеры, в которой был расположен контейнер (К) с источником α-частиц. Окно камеры было закрыто металлической фольгой (Ф), толщина которой была подобрана так, чтобы α-частицы не могли через нее проникнуть. За окном располагался экран (Э), покрытый сернистым цинком. С помощью микроскопа (М) можно было наблюдать сцинтилляции в точках попадания на экран тяжелых заряженных частиц. При заполнении камеры азотом при низком давлении на экране возникали световые вспышки, указывающие на появление потока каких-то частиц, способных проникать через фольгу (Ф), практически полностью задерживающую поток α-частиц. Отодвигая экран (Э) от окна камеры, Резерфорд измерил среднюю длину свободного пробега наблюдаемых частиц в воздухе. Она оказалась приблизительно равной 28 см, что совпадало с оценкой длины пробега H-частиц, наблюдавшихся ранее Дж. Томсоном. Исследования действия на частицы, выбиваемые из ядер азота, электрических и магнитных полей показали, что эти частицы обладают положительным элементарным зарядом и их масса равна массе ядра атома водорода. Впоследствии опыт был выполнен с целым рядом других газообразных веществ. Во всех случаях было обнаружено, что из ядер этих веществ α-частицы выбивают H-частицы или протоны. По современным измерениям, положительный заряд протона в точности равен элементарному заряду e = 1,60217733·10–19 Кл, то есть, равен по модулю отрицательному заряду электрона. В настоящее время равенство зарядов протона и электрона проверено с точностью 10–22. Такое совпадение зарядов двух непохожих друг на друга частиц вызывает удивление и остается одной из фундаментальных загадок современной физики. Масса протона, по современным измерениям, равна mp = 1,67262·10–27 кг. Таким образом, в опыте Резерфорда было открыто явление расщепления ядер азота и других элементов при ударах быстрых α-частиц и показано, что протоны входят в состав ядер атомов. После открытия протона было высказано предположение, что ядра атомов состоят из одних протонов. Однако это предположение оказалось несостоятельным, так как отношение заряда ядра к его массе не остается постоянным для разных ядер, как это было бы, если бы в состав ядер входили одни протоны. Для более тяжелых ядер это отношение оказывается меньше, чем для легких, т. е. при переходе к более тяжелым ядрам масса ядра растет быстрее, чем заряд. В 1920 г. Резерфорд высказал гипотезу о существовании в составе ядер жестко связанной компактной протон-электронной пары, представляющей собой электрически нейтральное образование – частицу с массой, приблизительно равной массе протона. Он даже придумал название этой гипотетической частице – нейтрон. Это была очень красивая, но, как выяснилось впоследствии, ошибочная идея. Электрон не может входить в состав ядра. Квантово-механический расчет на основании соотношения неопределенностей показывает, что электрон, локализованный в ядре, т. е. области размером R ≈ 10–13 см, должен обладать колоссальной кинетической энергией, на много порядков превосходящей энергию связи ядер в расчете на одну частицу. Идея о существовании тяжелой нейтральной частицы казалась Резерфорду настолько привлекательной, что он незамедлительно предложил группе своих учеников во главе с Дж. Чедвиком заняться поиском такой частицы. Через 12 лет в 1932 г. Чедвик экспериментально исследовал излучение, возникающее при облучении бериллия α-частицами, и обнаружил, что это излучение представляет собой поток нейтральных частиц с массой, примерно равной массе протона. Так был открыт нейтрон. На рис. 6. приведена упрощенная схема установки для обнаружения нейтронов.
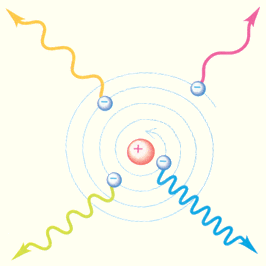
При бомбардировке бериллия α-частицами, испускаемыми радиоактивным полонием, возникает сильное проникающее излучение, способное преодолеть такую преграду, как слой свинца толщиной в 10–20 см. Это излучение почти одновременно с Чедвиком наблюдали супруги Жолио-Кюри Ирен и Фредерик (Ирен – дочь Марии и Пьера Кюри), но они предположили, что это γ-лучи большой энергии. Они обнаружили, что если на пути излучения бериллия поставить парафиновую пластину, то ионизирующая способность этого излучения резко возрастает. Они доказали, что излучение бериллия выбивает из парафина протоны, которые в большом количестве имеются в этом водородосодержащем веществе. По длине свободного пробега протонов в воздухе они оценили энергию γ-квантов, способных при столкновении сообщить протонам необходимую скорость. Она оказалась огромной – порядка 50 МэВ. Дж. Чедвик в 1932 г. выполнил серию экспериментов по всестороннему изучению свойств излучения, возникающего при облучении бериллия α-частицами. В своих опытах Чедвик использовал различные методы исследования ионизирующих излучений. Счетчик Гейгера, предназначенный для регистрации заряженных частиц. Он состоит из стеклянной трубки, покрытой изнутри металлическим слоем (катод), и тонкой нити, идущей вдоль оси трубки (анод). Трубка заполняется инертным газом (обычно аргоном) при низком давлении. Заряженная частица, пролетая в газе, вызывает ионизацию молекул. Появившиеся в результате ионизации свободные электроны ускоряются электрическим полем между анодом и катодом до энергий, при которых начинается ударная ионизация. Возникает лавина ионов, и через счетчик проходит короткий разрядный импульс тока. Другим важнейшим прибором для исследования частиц является так называемая камера Вильсона, в которой быстрая заряженная частица оставляет след (трек). Траекторию частицы можно наблюдать непосредственно или фотографировать. Действие камеры Вильсона, созданной в 1912 г., основано на конденсации перенасыщенного пара на ионах, образующихся в рабочем объеме камеры вдоль траектории, заряженной частицы. С помощью камеры Вильсона можно наблюдать искривление траектории заряженной частицы в электрическом и магнитном полях. Дж. Чедвик в своих опытах наблюдал в камере Вильсона треки ядер азота, испытавших столкновение с бериллиевым излучением. На основании этих опытов он сделал оценку энергии γ-кванта, способного сообщить ядрам азота наблюдаемую в эксперименте скорость. Она оказалась равной 100–150 МэВ. Такой огромной энергией не могли обладать γ-кванты, испущенные бериллием. На этом основании Чедвик заключил, что из бериллия под действием α-частиц вылетают не безмассовые γ-кванты, а достаточно тяжелые частицы. Поскольку эти частицы обладали большой проникающей способностью и непосредственно не ионизировали газ в счетчике Гейгера, следовательно, они были электронейтральны. Так было доказано существование нейтрона – частицы, предсказанной Резерфордом более чем за 10 лет до опытов Чедвика. Нейтрон – это элементарная частица. Ее не следует представлять в виде компактной протон-электронной пары, как первоначально предполагал Резерфорд. По современным измерениям, масса нейтрона mn = 1,67493·10–27 кг = 1,008665 а. е. м. В энергетических единицах масса нейтрона равна 939,56563 МэВ. Масса нейтрона приблизительно на две электронные массы превосходит массу протона. Также, важным следствием теории Резерфорда было указание на заряд атомного центра, который Резерфорд положил равным ±Ne. Заряд оказался пропорциональным атомному весу. "Точное значение заряда центрального ядра не было определено, писал Резерфорд, - но для атома золота оно приблизительно равно 100 единицам заряда". Из последующих исследований и экспериментов Гейгера и Мардсена, предпринявших проверку формул Резерфорда, возникло представление о ядре как устойчивой части атома, несущей в себе почти всю массу атома и обладающей положительным (Резерфорд считал знак заряда неопределенным) зарядом. При этом число элементарных зарядов оказалось пропорциональным атомному весу. Заряд ядра оказался важнейшей характеристикой атома. В 1913 году было показано, что заряд ядра совпадает с номером элемента в таблице Менделеева. Бор писал: "С самого начала было ясно, что благодаря большой массе ядра и его малой протяженности в пространстве сравнительно с размерами всего атома строение электронной системы должно зависеть почти исключительно от полного электрического заряда ядра. Такие рассуждения сразу наводили на мысль о том, что вся совокупность физических и химических свойств каждого элемента может определяться одним целым числом..." После знакомства с Резерфордом Бор, отказавшись от изучения электронной модели, начал работу в его группе. Обратившись к планетарной модели, Бор создал на ее основе теорию атома Резерфорда-Бора. Резерфорд понял революционный характер идей Бора и обсудил с ним основы этой теории, высказал критические замечания, после чего статьи Бора были опубликованы. Открытие Резерфордом атомных ядер является основой всех современных теорий строения атома. Когда Нильс Бор через два года опубликовал знаменитый труд, описывающий атом как миниатюрную солнечную систему, управляемую квантовой механикой, он использовал для своей модели в качестве отправной точки ядерную теорию Резерфорда. Так же поступили Гейзенберг и Шрёдингер, когда они сконструировали более сложные атомные модели, используя классическую и волновую механику. Итак , как мы уже говорили Планетарная модель атома, предложенная Резерфордом, – это попытка применения классических представлений о движении тел к явлениям атомных масштабов. Эта попытка оказалась несостоятельной. Классический атом неустойчив. Электроны, движущиеся по орбите с ускорением, должны неизбежно упасть на ядро, растратив всю энергию на излучение электромагнитных волн (рис. 7.).
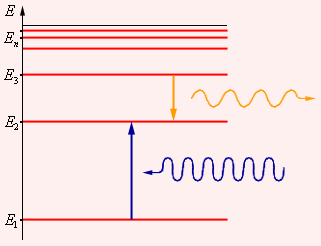
Следующий шаг в развитии представлений об устройстве атома сделал в 1913 году выдающийся датский физик Н. Бор. Проанализировав всю совокупность опытных фактов, Бор пришел к выводу, что при описании поведения атомных систем следует отказаться от многих представлений классической физики. Он сформулировал постулаты, которым должна удовлетворять новая теория о строении атомов. Первый постулат Бора (постулат стационарных состояний) гласит: атомная система может находиться только в особых стационарных или квантовых состояниях, каждому из которых соответствует определенная энергия En. В стационарных состояниях атом не излучает. Этот постулат находится в явном противоречии с классической механикой, согласно которой энергия движущегося электрона может быть любой. Он находится в противоречии и с электродинамикой, так как допускает возможность ускоренного движения электронов без излучения электромагнитных волн. Согласно первому постулату Бора, атом характеризуется системой энергетических уровней, каждый из которых соответствует определенному стационарному состоянию (рис. 8). Механическая энергия электрона, движущегося по замкнутой траектории вокруг положительно заряженного ядра, отрицательна. Поэтому всем стационарным состояниям соответствуют значения энергии En < 0. При En ≥ 0 электрон удаляется от ядра (ионизация). Величина |E1| называется энергией ионизации. Состояние с энергией E1 называется основным состоянием атома.
Второй постулат Бора (правило частот) формулируется следующим образом: при переходе атома из одного стационарного состояния с энергией En в другое стационарное состояние с энергией Em излучается или поглощается квант, энергия которого равна разности энергий стационарных состояний:
где h – постоянная Планка. Отсюда можно выразить частоту излучения:
Теория Бора не отвергла полностью законы классической физики при описании поведения атомных систем. В ней сохранились представления об орбитальном движении электронов в кулоновском поле ядра. Классическая ядерная модель атома Резерфорда была дополнена в теории Бора идеей о квантовании электронных орбит. Поэтому теорию Бора иногда называют полуклассической. Теория Бора позволила разрешить очень важный вопрос о расположении электронов в атомах различных элементов и установить зависимость свойств элементов от строения электронных оболочек их атомов. В настоящее время разработаны схемы строения атомов всех химических элементов. Однако, иметь ввиду, что все эти схемы это лишь более или менее достоверная гипотеза, позволяющая объяснить многие физические и химические свойства элементов. Как раньше уже было сказано, число электронов, вращающихся вокруг ядра атома, соответствует порядковому номеру элемента в периодической системе. Электроны расположены по слоям, т.е. каждому слою принадлежит определенное заполняющие или как бы насыщающее его число электронов. Электроны одного и того же слоя характеризуются почти одинаковым запасом энергии, т.е. находятся примерно на одинаковом энергетическом уровне. Вся оболочка атома распадается на несколько энергетических уровней. |
Copyright © 2012 г.
При использовании материалов - ссылка на сайт обязательна.
 Рисунок
4.
Рисунок
4.