|
|
МЕНЮ
|
Реферат: Открытие атомаРеферат: Открытие атома
а) Опыты Резерфорда б) Планетарная модель атома Резерфорда в) Квантовые постулаты Бора
а) История создания лазера б) Устройство лазера в) Свойства лазера · применения лазера в ювелирной отрасли · применения лазера в военном деле · применения лазера в медицине · лазеры как средство записи и обработки информации
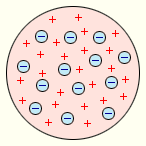
ВведениеАТОМА СТРОЕНИЕРаздел физики, изучающий внутреннее устройство атомов. Атомы, первоначально считавшиеся неделимыми, представляют собой сложные системы. Они имеют массивное ядро, состоящее из протонов и нейтронов, вокруг которого в пустом пространстве движутся электроны. Чтобы составить представление о размерах атома и незаполненности занимаемого им пространства, рассмотрим атомы, составляющие каплю воды диаметром 1 мм. Если мысленно увеличить эту каплю до размеров Земли, то атомы водорода и кислорода, входящие в молекулу воды, будут иметь в поперечнике 1–2 м. Основная же часть массы каждого атома сосредоточена в его ядре, поперечник которого при этом составил всего 0,01 мм. Атомы очень малы – их размеры порядка 10–10–10–9 м, а размеры ядра еще примерно в 100 000 раз меньше (10–15–10–14 м). Поэтому атомы можно «увидеть» только косвенным путем, на изображении с очень большим увеличением . Но и в этом случае атомы не удается рассмотреть в деталях. Наши знания об их внутреннем устройстве основаны на огромном количестве экспериментальных данных, которые косвенно, но убедительно свидетельствуют в пользу сказанного выше. АТОМ КАК ЦЕЛОЕИсторию возникновения самых общих представлений об атоме обычно ведут со времен греческого философа Демокрита , много размышлявшего о наименьших частицах, на которые можно было бы поделить любое вещество. Группу греческих философов, придерживавшихся того взгляда, что существуют подобные крошечные неделимые частицы, называли атомистами. Греческий философ Эпикур принял атомную теорию, и в первом веке до н.э., один из его последователей, римский поэт и философ Лукреций Кар, изложил учение Эпикура в поэме «О природе вещей», благодаря которой оно и сохранилось для следующих поколений. Аристотель, один из крупнейших ученых древности, атомистическую теорию не принимал, и его взгляды на философию и науку преобладали впоследствии в средневековом мышлении. Атомистической теории как бы не существовало до самого конца эпохи Возрождения, когда на смену чисто умозрительным философским рассуждениям пришел эксперимент. В эпоху Возрождения начались систематические исследования в областях, именуемых ныне химией и физикой, принесшие с собой новые догадки о природе «неделимых частиц». Р.Бойль (1627–1691) и Исаак Ньютон (1643–1727) исходили в своих рассуждениях из представления о существовании неделимых частиц вещества. Однако ни Бойлю, ни Ньютону не потребовалось детальной атомистической теории для объяснения интересовавших их явлений, и результаты проведенных ими экспериментов не сказали ничего нового о свойствах «атомов». попытки построить модель атома на основе представлений классической электродинамики и механики. В 1904 году появились публикации о строении атома, одни из которых принадлежали японскому физику Хантаро Нагаока, другие - английскому физику Д.Д. Томсону. Нагаока представил строение атома аналогичным строению солнечной системы: роль Солнца играет положительно заряженная центральная часть атома, вокруг которой по установленным кольцеобразным орбитам движутся “планеты” - электроны. При незначительных смещениях электроны возбуждают электромагнитные волны. Он считал, что атом представляет собой электронейтральную систему шарообразной формы радиусом примерно равным 10–10 м. Положительный заряд атома равномерно распределен по всему объему шара, а отрицательно заряженные электроны находятся внутри него (рис.1.). Для объяснения линейчатых спектров испускания атомов Томсон пытался определить расположение электронов в атоме и рассчитать частоты их колебаний около положений равновесия. Однако эти попытки не увенчались успехом. Через несколько лет в опытах великого английского физика Э. Резерфорда было доказано, что модель Томсона неверна.
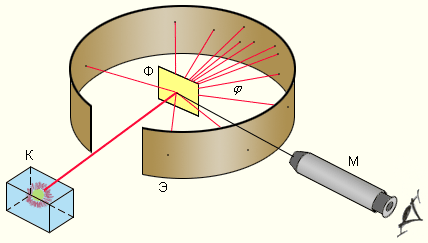
Модель атома Дж. Томсона. В атоме Томсона положительное электричество “распределено” по сфере, в которую вкраплены электроны. В простейшем атоме водорода электрон находится в центре положительно заряженной сферы. В многоэлектронных атомах электроны располагаются по устойчивым конфигурациям, рассчитанным Томсоном. Томсон считал каждую такую конфигурацию определяющей химические свойства атомов. Он предпринял попытку теоретически объяснить периодическую систему элементов Д.И. Менделеева. Научные основы атомно-молекулярного учения были заложены позднее в работах русского учёного М.В. Ломоносова, французских химиков Л. Лавуазье и Ж. Пруста, английского химика Д. Дальтона, итальянского физика А. Авогадро и других исследователей. Периодический закон Д.И. Менделеева показывает существование закономерной связи между всеми химическими элементами. Это говорит о том, что в основе всех атомов лежит нечто общее. До конца XIX века в химии царило убеждение, что атом есть наименьшая неделимая частица простого вещества. Считалось, что при всех химических превращениях разрушаются и создаются только молекулы, атомы же остаются неизменными и не могут дробиться на части. И, наконец, в конце XIX века были сделаны открытия, показавшие сложность строения атома и возможность превращения одних атомов в другие. Это послужило толчком к образованию и развитию нового раздела химии «Строение атома». Первым указанием на сложную структуру атома - были опыты по изучению катодных лучей, возникающих при электрическом разряде в сильно разреженных газах. Для наблюдения этих лучей из стеклянной трубки, в которую впаяны два металлических электрода, выкачивается по возможности весь воздух и затем пропускается сквозь нее ток высокого напряжения. При таких условиях от катода трубки перпендикулярно к его поверхности распространяются "невидимые" катодные лучи, вызывающие яркое зеленое свечение в том месте, куда они попадают. Катодные лучи обладают способностью приводить в движение. На их пути легко подвижные тела откланяются от своего первоначального пути в магнитном и электрическом поле (в последнем в сторону положительно заряженной пластины). Действие катодных лучей обнаруживается только внутри трубки, так как стекло для них непроницаемо. Изучение свойств катодных лучей привело к заключению, что они состоят из мельчайших частиц, несущих отрицательный заряд и летящих со скоростью, достигающей половины скорости света. Также удалось определить массу и величину их заряда. Масса каждой частицы равнялась 0,00055 углеродной частицы. Заряд равняется 1,602 на 10 в минус 19 степени. Особенно замечательно, что масса частиц и величина их заряда не зависит ни от природы газа, остающегося в трубке, ни от вещества из которого сделаны электроды, ни от прочих условий опыта. Кроме того, катодные частицы известны только в заряженном состоянии и не могут существовать без своих зарядов, не могут быть превращены в электронейтральные частицы: электрический заряд составляет, самую сущность их природы. Эти частицы получили название электронов. В катодных трубках электроны отделяются от катода под влиянием электрического заряда. Но они могут возникать и вне всякой связи с электрическим зарядом. Так, например, при электронной эмиссии металлы испускают электроны; при фотоэффекте многие вещества также выбрасывают электроны. Выделение электронов самыми разнообразными веществами указывает на то, что эти частицы входят в состав всех атомов; следовательно, атомы являются сложными образованиями, построенными из более мелких «составных частей». Уподобление атома планетной системе делалось еще в конце 19 века. Но эту модель было трудно совместить с моделями электродинамики, и она была оставлена, уступив место модели Томсона. Представления о строении атома радикально изменились в начале 20 века под влиянием новых теоретических идей и экспериментальных данных. Другие доказательства сложной структуры атома. В то самое время, когда Томсон и другие исследователи экспериментировали с катодными лучами, открытие рентгеновского излучения и радиоактивности принесло дополнительные доказательства сложной структуры атома. В 1895 В.Рентген (1845–1923) случайно обнаружил таинственное излучение («Х-лучи»), проникавшее сквозь черную бумагу, которой он оборачивал трубку Крукса при исследовании зеленой люминесцирующей области электрического разряда. Х-лучи вызывали свечение удаленного экрана, покрытого кристаллическим платиноцианидом бария. Рентген выяснил, что различные вещества разной толщины, введенные между экраном и трубкой, ослабляют свечение, но не гасят его полностью. Это свидетельствовало о чрезвычайно высокой проникающей способности Х-лучей. Рентген установил также, что эти лучи распространяются прямолинейно и не отклоняются под действием электрических и магнитных полей. Возникновение такого невидимого проникающего излучения при бомбардировке электронами различных материалов было чем-то совершенно новым. Было известно, что видимый свет от трубок Гейсслера состоит из отдельных «спектральных линий» с определенными длинами волн и, значит, связан с «колебаниями» атомов, имеющими дискретные частоты. Существенная особенность нового излучения, отличавшая его от оптических спектров, помимо высокой проникающей способности, состояла в том, что оптические спектры элементов с последовательно возраставшим числом электронов полностью отличались друг от друга, тогда как спектры X-лучей очень незначительно изменялись от элемента к элементу. Резерфорд родился 1871 и вырос в Новой Зеландии. Там он поступил в Кентерберийский колледж и к двадцати трем годам получил три степени (бакалавра гуманитарных наук, бакалавра естественных наук, магистра гуманитарных наук). На следующий год ему присудили право на обучение в Кембриджском университете в Англии, где он провел три года как студент-исследователь под руководством Дж. Дж. Томсона, одного из ведущих ученых того времени. В двадцать семь лет Резерфорд стал профессором физики в университете Макджил в Канаде. Там он работал девять лет и в 1907 году вернулся в Англию, чтобы возглавить физический факультет Манчестерского университета. В 1919 году Резерфорд вернулся в Кембридж, на этот раз как директор Кавендишской лаборатории, и оставался на этом посту до конца жизни. Личность Резерфорда постоянно поражала всех, кто с ним встречался. Он был крупным человеком с громким голосом, беспредельной энергией и заметным недостатком скромности. Когда коллеги отмечали сверхъестественную способность Резерфорда всегда находиться "на гребне волны" научных исследований, он сразу отвечал: "А почему бы и нет? Ведь это я вызвал волну, не так ли?" Немногие ученые стали бы возражать против этого утверждения. Э. Резерфорд начал свою научную карьеру с разгадки тайн радиоактивности – явления, открытого в 1896 году А. Беккерелем. Важная черта радиоактивности - это связанная с ней энергия. Беккерель, супруги Кюри и множество других ученых считали энергию внешним источником. Но Резерфорд доказал, что данная энергия, которая намного мощнее, чем освобождаемая при химических реакциях, - исходит изнутри отдельных атомов урана! Этим он положил начало важной концепции атомной энергии. Ученые всегда предполагали, будто отдельные атомы неделимы и неизменяемы. Но Резерфорд (с помощью очень талантливого молодого помощника Фредерика Содди) смог показать, что когда атом испускает альфа - или бета-лучи, он преобразуется в атом иного сорта. Сначала химики не могли в это поверить. Однако Резерфорд и Содди провели целую серию экспериментов с радиоактивным распадом и трансформировали уран в свинец. Также Резерфорд измерил скорость распада и сформулировал важную концепцию "полураспада". Это вскоре привело к технике радиоактивного исчисления, которое стало одним из важнейших научных инструментов и нашло широкое применение в геологии, археологии, астрономии и во многих других областях. Э.Резерфорд, исследовав проникающую способность излучения урана, показал, что имеются два типа излучений: очень «мягкое» излучение, которое легко поглощается веществом и которое Резерфорд назвал альфа-лучами, и более проникающее излучение, которое он назвал бета-лучами. Бета-лучи оказались тождественными обычным электронам, или «катодным лучам», возникающим в разрядных трубках. Альфа-лучи, как выяснилось, имеют такие же заряд и массу, как и атомы гелия, лишенные двух своих электронов. Третий тип излучения, названный гамма-лучами, оказался сходен с X-лучами, но обладал еще большей проникающей способностью. Эта ошеломляющая серия открытий принесла Резерфорду в 1908 году Нобелевскую премию (позже Нобелевскую премию получил и Содди), но его величайшее достижение было еще впереди. Он заметил, что быстродвижущиеся альфа-частицы способны проходить сквозь тонкую золотую фольгу (не оставляя видимых следов!), но при этом слегка отклоняются. Возникло предположение, что атомы золота, твердые, непроницаемые, как "крошечные бильярдные шары" - как ранее считали ученые, - были мягкими внутри! Все выглядело так, будто меньшие и более твердые альфа-частицы могут проходить сквозь атомы золота как высокоскоростная пуля через желе. Резерфорд с помощью своих сотрудников. Э.Мардсена и Х. Гейгера в 1909-1911 годах применил зондирование атома с помощью α-частиц, которые возникают при радиоактивном распаде радия и некоторых других элементов. Масса α-частиц приблизительно в 7300 раз больше массы электрона, а положительный заряд равен удвоенному элементарному заряду. В своих опытах Резерфорд использовал α-частицы с кинетической энергией около 5 МэВ (скорость таких частиц очень велика – порядка 107 м/с, но она все же значительно меньше скорости света). α-частицы – это полностью ионизированные атомы гелия. Они были открыты Резерфордом в 1899 году при изучении явления радиоактивности. Этими частицами Резерфорд бомбардировал атомы тяжелых элементов (золото, серебро, медь и др.). Электроны, входящие в состав атомов, вследствие малой массы не могут заметно изменить траекторию α-частицы. Рассеяние, то есть изменение направления движения α-частиц, может вызвать только тяжелая положительно заряженная часть атома. Схема опыта Резерфорда представлена на рис. 2.
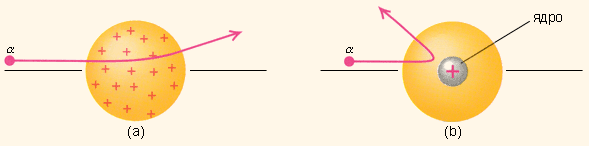
От радиоактивного источника, заключенного в свинцовый контейнер, α-частицы направлялись на тонкую металлическую фольгу. Рассеянные частицы попадали на экран, покрытый слоем кристаллов сульфида цинка, способных светиться под ударами быстрых заряженных частиц. Сцинтилляции (вспышки) на экране наблюдались глазом с помощью микроскопа. Наблюдения рассеянных α-частиц в опыте Резерфорда можно было проводить под различными углами φ к первоначальному направлению пучка. Было обнаружено, что большинство α-частиц проходит через тонкий слой металла, практически не испытывая отклонения. Однако небольшая часть частиц отклоняется на значительные углы, превышающие 30°. Очень редкие α-частицы (приблизительно одна на десять тысяч) испытывали отклонение на углы, близкие к 180°. Но Резерфорд обнаружил, что некоторые α-частицы, проходя сквозь золотую фольгу, отклоняются очень сильно. Фактически некоторые вообще отлетают назад! Почувствовав, что за этим кроется нечто важное, ученый тщательно посчитал количество частиц, полетевших в каждом направлении. Затем путем сложного, но вполне убедительного математического анализа он показал единственный путь, которым можно было объяснить результаты экспериментов: атом золота состоял почти полностью из пустого пространства, а практически вся атомная масса была сконцентрирована в центре, в маленьком "ядре" атома! Этот результат был совершенно неожиданным даже для Резерфорда. Он находился в резком противоречии с моделью атома Томсона, согласно которой положительный заряд распределен по всему объему атома. При таком распределении положительный заряд не может создать сильное электрическое поле, способное отбросить α-частицы назад. Электрическое поле однородного заряженного шара максимально на его поверхности и убывает до нуля по мере приближения к центру шара. Если бы радиус шара, в котором сосредоточен весь положительный заряд атома, уменьшился в n раз, то максимальная сила отталкивания, действующая на α-частицу по закону Кулона, возросла бы в n2 раз. Следовательно, при достаточно большом значении n α-частицы могли бы испытать рассеяние на большие углы вплоть до 180°. Эти соображения привели Резерфорда к выводу, что атом почти пустой, и весь его положительный заряд сосредоточен в малом объеме. Эту часть атома Резерфорд назвал атомным ядром. Так возникла ядерная модель атома. Рис. 3 иллюстрирует рассеяние α-частицы в атоме Томсона и в атоме Резерфорда.
|
Copyright © 2012 г.
При использовании материалов - ссылка на сайт обязательна.
 Рисунок
1.
Рисунок
1.