|
|
МЕНЮ
|
Учебное пособие: Металлы и сплавы
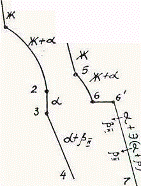
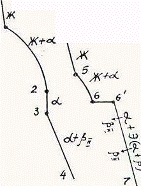
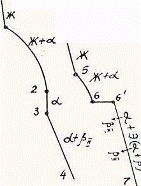
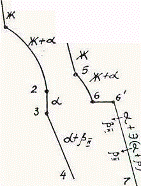
Рис. 5.5. Построение диаграммы состояния «никель-медь» по кривым охлаждения Кривые охлаждения 1 и 5 характеризуют кристаллизацию никеля и меди при постоянной температуре, равной температуре их плавления. Кристаллизация всех других сплавов (кривые 2, 3, 4) протекает при переменной температуре, и характер кривых охлаждения для всех сплавов будет один и тот же. Перенеся критические точки с кривых охлаждения на ординаты с соответствующим составом сплавов и соединив одноименные точки линиями, получим верхнюю, слегка выпуклую, линию - линию начала кристаллизации (ликвидус) и нижнюю, слегка вогнутую, линию - линию конца кристаллизации (солидус). На этой диаграмме выше линии ликвидус все сплавы представляют собой жидкий раствор компонентов, между линиями ликвидус и солидус - жидкий и твердый (a) растворы, а ниже линии солидус все сплавы однофазны и состоят из a-твердого раствора. Кристаллизация сплавов данной системы начинается ниже линии ликвидус и заключается в выделении из жидкого раствора кристаллов твердого раствора. Состав жидкой фазы при понижении температуры будет изменяться по линии ликвидус, состав твердой фазы – по линии солидус. В момент окончания процесса кристаллизации при достаточной скорости диффузии концентрация твердого раствора должна быть равна исходной концентрации сплава. Как и в предыдущем случае, в двухфазной области между линиями ликвидус и солидус для любой точки можно определить фазовый состав, концентрацию фаз и их количественное соотношение. Например, возьмем точку М, проведем через нее коноду, которая пересечет линию ликвидус в точке «в», а линию солидус в точке «а». Состав жидкой фазы в точке М определяется абсциссой точки «в», а именно «в¢» а состав твердой фазы - координатой точки «а», т.е. «а¢». Количество твердой фазы
количество жидкой фазы
Так как все сплавы в твердом состоянии представляют собой однофазный твердый раствор, то микроструктура всех сплавов будет однотипной. На микрошлифах выявляются только границы зерен. Кроме того, чем больше в сплаве меди, тем более розовой будет его структура, приближаясь постепенно к цвету меди. Диаграмма состояния сплавов с ограниченной растворимостью компонентов друг в друге в твердом состоянии Сплавы, затвердевающие в соответствии с диаграммой состояния ограниченных твердых растворов, характеризуются тем, что в жидком состоянии компоненты растворяются друг в друге неограниченно, а в твердом состоянии образуют ограниченные твердые растворы и эвтектику. Такой тип диаграммы имеют сплавы системы: алюминий-медь, алюминий-кремний, серебро-медь, свинец-олово и др. В системах такого типа не образуются фазы, представляющие собой чистые компоненты. Из жидкой фазы могут выделяться только твердые растворы a и b. a-твердый раствор - раствор компонента В в компоненте А, т.е. А (В). b-твердый раствор - раствор компонента А в компоненте В, т.е. В (А). Следовательно, около вертикали А расположена область существования a-твердого раствора на основе компонента А. Эта область - А¢QЕА. Максимальная растворимость компонента В в компоненте А при комнатной температуре определяется отрезком А¢Q. Предельная же растворимость В в А в зависимости от температуры характеризуется кривой QЕА. Около вертикали В расположена область b-твердого раствора компонента А в компоненте В (В¢F¢FВ). Растворимость компонента А в компоненте В при комнатной температуре и при температуре до точки F определяется отрезком F¢В¢, далее она изменяется по линии FВ. Линия АСВ является линией ликвидус, АЕСFВ - линией солидус.
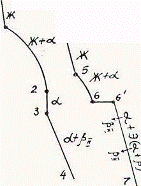
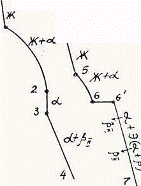
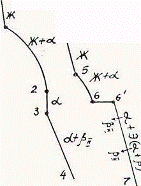
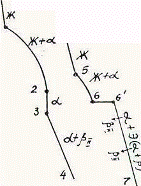
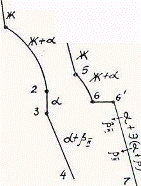
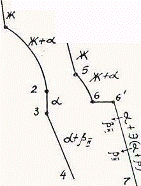
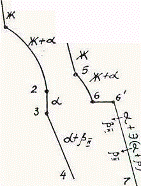
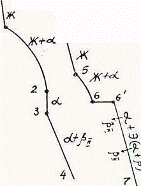
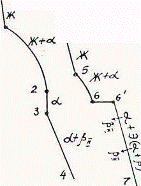
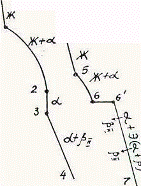
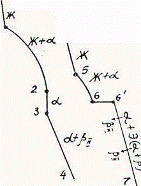
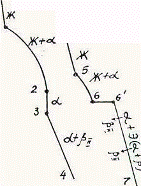
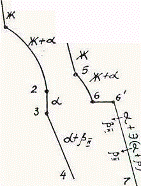
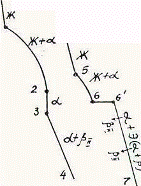
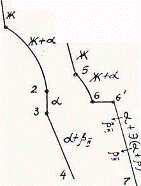
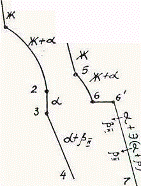
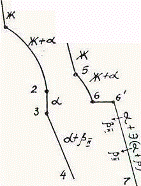
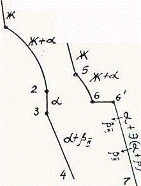
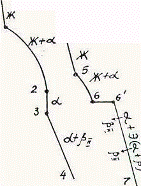
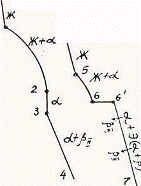
Зная правило фаз и правило отрезков, можно проследить за процессом кристаллизации любого сплава и определить структурный и фазовый составы во всех областях диаграммы. Рассмотрим сплав I В точке 1 начинается процесс кристаллизации. Из жидкой фазы выделяются кристаллы a-твердого раствора, состав которого изменяется по кривой а-2. Состав жидкой фазы при этом изменяется по кривой 1-в. В точке 2 кристаллизация заканчивается. Кристаллы твердого раствора имеют состав исходного жидкого сплава. Ниже точки 3, лежащей на линии предельной растворимости, твердый раствор a становится пересыщенным и из него выделяются избыточные кристаллы твердого раствора b. Состав твердого раствора a изменяется по линии 3-Q. Состав выделяющейся b-фазы определяется концентрацией F¢, а ее количество - отрезками от линии сплава 3-4 до кривой 3-Q, отнесенными к отрезку 4-F¢. Кристаллы b, выделяющиеся из жидкости при первичной кристаллизации, являются первичными и записываются с индексом (bI) или без него (b). Кристаллы, выделяющиеся из твердого раствора, обозначаются bII (b-вторичные). У сплавов с концентрацией левее точки Q вторичные выделения b-кристаллов отсутствуют. Поскольку растворимость компонента А в компоненте В по линии F-F¢ в данном случае постоянна, то вторичных выделений a-кристаллов из b-фазы не происходит. Рассмотрим сплав II. В этом сплаве ниже точки 5 кристаллизуется a-фаза. Состав жидкой фазы при этом изменяется по линии 5-с, а твердой a-фазы - по линии е-Е . В точке 6 жидкая фаза имеет эвтектический состав (точки С) и кристаллизуется с образованием эвтектики при постоянной температуре. Состав a-фазы в точке 6 определяется координатой точки Е(Е¢),а состав b-фазы - координатой точки F(F¢). При охлаждении сплава II ниже температуры точки 6 из a-фазы (свободной и входящей в состав эвтектики) будет выделяться избыточное количество компонента В в виде bII по закону предельной растворимости (линия ЕQ). При комнатной температуре состав a-фазы будет соответствовать точке Q. Свойства сплавов зависят от типа диаграммы состояния, состава и структуры сплавов. Метод построения диаграмм "состав-свойство" был разработан Н.С. Курнаковым, открывшим определенную зависимость между свойствами сплавов и диаграммой состояния. На рис. 5.6 изображены диаграммы "состав-свойства" в зависимости от вида диаграмм состояния (по Н.С. Курнакову).
Рис. 5.6. Диаграммы состояния и соответствующие им диаграммы «состав-свойства» Анализ этих диаграмм позволяет сделать следующие выводы: - для повышения прочности целесообразно применять легирующие элементы, образующие с основным металлом твердые растворы или химические соединения; - сплавы с переменной растворимостью легирующего элемента в основном металле можно упрочнять термообработкой; - в качестве литейных сплавов лучше применять сплавы, содержащие эвтектику, так как они обладают низкой температурой кристаллизации и хорошей жидкотекучестью; - однофазные сплавы имеют лучшую свариваемость и коррозионную стойкость; - двухфазные сплавы лучше обрабатываются резанием; - литейные сплавы с дендритной структурой лучше сопротивляются истиранию. Задание и методические рекомендации 1. Ознакомиться с диаграммами состояния различных типов, указать в отчете значения линий и точек диаграммы, а также фазовый состав сплавов в различных областях диаграммы. 2. В точке, заданной преподавателем, определить концентрацию и относительное количество фаз графическим и расчетным методами. Оценить свойства сплава указанной концентрации и его технологические особенности. 3. Изучить и зарисовать структуру сплавов системы "свинец-сурьма" различного состава, а также сплава системы Ni-Cu заданного состава. 4. По указанию преподавателя построить кривые охлаждения для различных сплавов. Контрольные вопросы 1. Что такое фаза, компоненты, система сплавов? 2. Как строятся диаграммы состояния и какие основные свойства сплавов можно выявить с их помощью? 3. Какие типы диаграмм состояния могут образовывать между собой различные компоненты? От чего зависит тот или иной тип диаграммы? 4. Как определить фазовый состав, концентрацию фаз и количественное соотношение между фазами с помощью коноды? 5. Как изменяются свойства сплавов в зависимости от их состава и типа диаграммы состояния? Лабораторная работа № 6 Диаграмма состояния «железо-цементит». Структура, свойства и применение железоуглеродистых сплавов Цель работы1. Рассмотреть и изучить свойства основных фаз и сложных структур в сплавах железа с углеродом. 2. Изучить диаграмму состояния "железо-цементит", рассмотрев процесс кристаллизации жидкого сплава и превращения в сплавах в твердом состоянии. 3. Изучить структуры углеродистых сталей с различным содержанием углерода и различных марок чугунов. Установить связь структуры материалов с их свойствами. Определить области применения различных сталей и чугунов. Теоретические сведения К железоуглеродистым сплавам относят стали (содержание углерода - до 2,14%) и чугуны (содержание углерода - свыше 2,14%), которые по масштабу и многообразию своего применения имеют важное значение для современной техники. Чтоб разобраться в сложных и разнообразных структурных превращениях в сплавах на основе железа и сознательно воздействовать на них путем термообработки для получения требуемых свойств, необходимо рассмотреть превращения в железоуглеродистых сплавах в условиях фазового равновесия, т.е. ознакомиться с диаграммой состояния «железо-углерод». Компоненты и фазы в системе «железо-углерод»Железо – металл серебристо-серого цвета, очень пластичный, с удельным весом 7,8 г/см3, температурой плавления 1539°С. Оно имеет несколько аллотропических превращений (аллотропия, или полиморфизм, – способность некоторых веществ при одном и том же химическом составе изменять тип кристаллической решетки, а следовательно, иметь различные свойства), которые наглядно показаны на кривой охлаждения чистого железа (рис. 6.1). В процессе кристаллизации из жидкой фазы при температуре 1539°С образуются кристаллы d-железа с объемно центрированной кубической кристаллической решеткой (ОЦК), которое обозначается Fed. При дальнейшем охлаждении d-железо сохраняется до температуры 1392°С, при которой происходит полиморфное превращение d-железа в g-железо с гранецентрированной кубической кристаллической решеткой (ГЦК), которое обозначается Feg; g-железо устойчиво до температуры 911°С. При температуре 911°С опять происходит полиморфное превращение g-железа в b-железо с ОЦК кристаллической решеткой (обозначается Feb).
Рис. 6.1. Кривая охлаждения чистого железа При температуре 768°С (точка Кюри) наблюдается магнитное превращение, в результате которого образуется ферромагнитное a-железо с ОЦК кристаллической решеткой, которое обозначается Fea. Модификации железа a, b и d обладают одной и той же ОЦК кристаллической решеткой. Следовательно, самостоятельными кристаллическими модификациями железа являются только a- и g-железо. Обозначение критических точек железа. Температуры полиморфных превращений железа принято называть критическими точками и обозначать их буквой А с соответствующими индексами 2, 3, 4, указывающими на характер превращения. Чтобы отличить превращения, протекающие в железоуглеродистых сплавах при нагревании, от превращений при охлаждении принято к обозначению критических точек добавлять: при нагревании - индекс с, при охлаждении - индекс r. Например, точка А3 обозначает температуру аллотропического превращения Fea«Feg. Углерод – неметаллический элемент с удельным весом 2,265 г/см3, температурой плавления 3500°С. Углерод имеет две аллотропические модификации: графита и алмаза. В форме графита в сплавах углерод встречается только в серых чугунах. В железоуглеродистых сплавах присутствуют следующие твердые фазы: Аустенит (А) – твердый раствор внедрения углерода в g-железе. Аустенит имеет кубическую гранецентрированную кристаллическую решетку. Растворимость углерода в Feg зависит от температуры: чем выше температура, тем больше растворимость. Максимальная растворимость углерода в Feg равна 2,14% при температуре 1147°С, при температуре 727°С растворимость равна 0,8%. Аустенит обладает высокой пластичностью, низкими пределами текучести и прочности. Твердость НВ составляет 170…220. Страницы: 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16 |
Copyright © 2012 г.
При использовании материалов - ссылка на сайт обязательна.