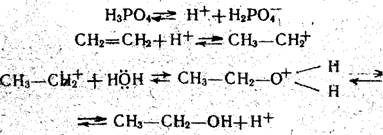|
|
МЕНЮ
|
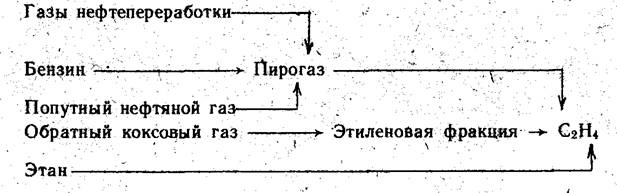
Курсовая работа: Методические разработки урока по теме "Спирты"Курсовая работа: Методические разработки урока по теме "Спирты"ВВЕДЕНИЕ Получение этанола — одно из крупнотоннажных промышленных производств основного (тяжелого) органического синтеза. При его изучении можно проследить основные тенденции технического прогресса в химической промышленности. Большие масштабы производства этанола предъявляют определенные требования к экономике производства, в первую очередь в решении проблемы выбора сырья (в себестоимости химической продукции доля сырья достигает 70 %) и рационального оформления технологического процесса. Кроме того, эти требования направлены на сокращение числа стадий производства; укрупнение единичных Мощностей аппаратов и установок в целом; повышение комплексности использования сырья; создание малоотходных технологических процессов; обеспечение необходимых мер по охране окружающей среды; максимальное внедрение на всех стадиях производства АСУ. ГЛАВА 1. ПРОИЗВОДСТВО ЭТАНОЛА ФЕРМЕНТАЦИЕЙ БИОМАССЫ Получение этанола. Обычно этанол получают отгонкой, и, по всей вероятности, этот способ будет применяться и в ближайшем будущем. Отгонка производится в колоннах путем последовательного отделения этанола от других компонентов жидкой фазы. Отделение барды. В первой колонне отделяются продукты ферментации (главным образом этанол) и некоторое количество воды от неферменти-рующихся твердых веществ в жидкой фазе (барде). Эта колонна обычно называется «пивным перегонным кубом». Желательно, чтобы на этом этапе из жидкой среды был отогнан весь этанол. В некоторых конструкциях колонн возможно увеличение концентрации этанола в верхнем погоне путем ректификации. Для отделения твердых веществ из жидкой фазы, движущейся вниз, предусмотрена отпарная секция. Производство безводного этанола. Последовательность перегонки после «пивного перегонного куба» зависит от требований, предъявляемых к этанолу. При производстве пищевого этанола последний должен быть очищен в соответствии с требованиями спецификаций на этанол или продукт, в котором он будет использован. При производстве этанола промышленного назначения необходимо удалить из него все загрязняющие вещества, в том числе сивушные масла, которые являются побочными продуктами ферментации. При получении безводного к очищенному продукту добавляют вещества, разрушающие водно-этанольную азеотропную смесь. Этанол и азотообразующую компоненту отделяют друг от друга в следующей колонне. В стандартных условиях для производства безводного этанола требуется по крайней мере четырехкратная перегонка. Этанол, предназначенный для использования в качестве топлива, не должен содержать воду [8]. Вместе с тем предполагается, что из такого этанола нет необходимости отделять сивушные масла. Поэтому перегонная система для получения этанола, предназначенного для использования в качестве топлива, включает «пивной перегонный куб» с ректификацией и колонны для азеотропной перегонки и отпарки. Спецификации на готовый продукт. Количество энергии, расходуемой на очистку этанола, определяет числа действующих колонн. В каждой колонне для поддержания заданного равновесия паров и жидкости над тарелками расходуется значительное количество тепловой энергии. Поэтому с энергетической точки зрения важное значение имеет спецификация на готовый продукт. В зависимости от спецификации и гибкости установки для производства более широкого ассортимента продуктов эксплуатационные расходы могут возрасти больше или меньше. Глава 2. ЭКОЛОГИЧЕСКИЕ И ЭКОНОМИЧЕСКИЕ АСПЕКТЫ ПРОИЗВОДСТВА ЭТАНОЛА Получение этанола — одно из крупнотоннажных промышленных производств основного (тяжелого) органического синтеза. При его изучении можно проследить основные тенденции технического прогресса в химической промышленности. Большие масштабы производства этанола предъявляют определенные требования к экономике производства, в первую очередь в решении проблемы выбора сырья (в себестоимости химической продукции доля сырья достигает 70 %) и рационального оформления технологического процесса. Кроме того, эти требования направлены на сокращение числа стадий производства; укрупнение единичных Мощностей аппаратов и установок в целом; повышение комплексности использования сырья; создание малоотходных технологических процессов; обеспечение необходимых мер по охране окружающей среды; максимальное внедрение на всех стадиях производства АСУ. Этанол (метилкарбинол, этиловый, винный спирт) известен человеку с глубокой древности. Первые упоминания о нем относятся к VIII в. В арабских источниках (950 г.) описано получение водного этанола. В 1050—1150 гг. этанол получали ректификацией вина, в котором он образуется при брожении глюкозы, и использовали под названиями «aqua ardens» («вода горючая»), «aqua vitae («вода жизни»), «spiritus vinb («дух вина»). Последний термин удержался в фармакологии до настоящего времени, С XIII в. этанол стали применять в медицине под названиями «мать», «государыня», «царица всех, лекарств». К 1440 г. относится исследование состава спирто-водных смесей (водки). С 1600 г. этанол используют в химических опытах для экстракции органических веществ. В книге А. Либавия «Алхимия» (1597) приведен проект химической лаборатории, в которой предусмотрен «винный погреб». В 1682 г. И. Бехер впервые описал метод получения водного этанола (водки) из картофеля, а в 1748 г. он опубликовал сообщение Шведской академии наук о промышленном способе получения этанола из картофеля. Попытка получить в 1775 г. Т. Бергманом. Впервые безводный этанол получил Т. Е.Ловиц в 1796 г. В 1798 г. А. Арганд описал применение метода ректификации для перегонки этанола. Однако только в 1820 г. для этой цели была сконструирована промышленная ректификационная колонна. В 1783 г. А. Лавуазье установил элементный состав этанола и попытался объяснить природу спиртового брожения. Окончательно химизм этого процесса был выяснен в XIX в. Исследование Д. И. Менделеевым в 1864 г. систем «этанол — вода» стало основой для разработки им гидратной (химической) теории растворов. До 1934 г. в стране этанол получали исключительно из пищевого сырья. В 1934 г. было освоено производство этанола гидролизом древесины, а в 1935 г. построен первый гидролизный завод в Ленинграде. С 1930 г. в стране велись работы по получению этанола сернокислотной гидратацией этилене, ив 1936 г, вступил в строй опытный завод в Баку. Поиски технологического решения производства этанола методом прямой f-идратации этилена были прерваны войной. В 1952 г. поэтому методу началось освоение производства этанола в г. Сумгаите, а в период с 1953 по 1958 г. вошли в строй заводы в Саратове, Уфе, Грозном, Самаре. В результате этих работ к 1960 г. доля синтетического этанола достигла уже 25 % в общем объеме его производства. В 1988 г. на основе этилена было получено 26,5 дал. этанола, что эквивалентно 2,7 млн. тонн картофеля или 0,86 млн. тонн зерна. Однако, несмотря на более низкую себестоимость -синтетического этанола, его доля в общем балансе продукции возрастала медленно. Так, в 1975 г. в СССР пищевой этанол составлял 60,0%, синтетический — 26,7%, гидролизный — 8,3%, в то время как в США уже в 1970 г. производство синтетического этанола достигло 83 %. С 1964 г. в стране было полностью прекращено использование для технических целей этанола, полученного из пищевого сырья, что отвечало решению общей задачи по сокращению доли пищевого сырья в сырьевом балансе химической промышленности. Разработка промышленных методов производства этанола из этилена и гидролизом древесины позволила в свое время решить в стране важнейшую народнохозяйственную задачу по увеличению производства мономеров для синтетических каучуков (бутадиен-1,3) и переводу производства на дешевое непищевое сырье. В настоящее время перевод производства бутадиена на углеводородное сырье (бутана и бутилен-дивинильная фракция продуктов пиролиза) высвобождает значительное количество синтетического этанола. Его предполагается использовать как сырье для производства кормовых дрожжей — белковых добавок к кормам, по качеству значительно превосходящих кормовой белок из парафина, а само производство не будет столь вредным в экологическом аспекте. В этой связи экономически целесообразна схема производства, основывающаяся на этане природного газа, который у нас в настоящее время не находит должного применения и, как правило, его сжигают. Таким образом, значение технологического процесса получения синтетического этанола не только сохраняется, но и возрастает, так как потребность в этом продукте для указанной цели в 5—10 раз превышает уровень его современного производства. В связи с этим гидролизные заводы переводят на производство кормовых дрожжей и производство гидролизного этанола прекращается.' Это в свою очередь вызывает необходимость вновь использовать часть мощностей по производству этанола из пищевого сырья для получения спирта высокой чистоты для специальных технических целей. Этанол образует с водой азеотропную смесь (95,67 % этанола), кипящую при 78,15 °С, поэтому получение безводного (абсолютного) этанола требует специальных методов обезвоживания! Он обладает наркотическим действием (ПДК=1000 мг/м3). Этанол относится к числу важнейших продуктов основного органического синтеза. Это сырье для производства ацетальдегида, хлороформа, диэтилового эфира, сложных эфиров органических кислот, пищевой уксусной кислоты, бутадиена, лекарственных препаратов. Его используют в качестве растворителя, антисептика, компонента моторных топлив, применяют в пищевой и парфюмерной промышленности. На основе разбавленных растворов этанола разработано производство кормовых дрожжей методы производства, этанола. В основу классификации всех существующих промышленных методов производства этанола могут быть положены виды используемого сырья (углеводородные газы, древесина, пищевые продукты, отходы производства) и химизм превращений (гидратация, брожение), лежащих в основе технологических процессов (схема 1). В соответствии с этой классификацией различают производства синтетического (I), гидролизного (II), ферментативного (пищевого) (III) и сульфитного (IV) этанола. Выход этанола существенно зависит от вида сырья и составляет (в л на 1 т сырья): для этилена — 740, картофеля -г 93— 117, зерна — 185—361, мелассы — 270—300, древесины — 160—200, сульфитных щелоков — 90—110 (в расчете на 1 т древесины). При использовании в качестве сырья древесины и сульфитных щелоков помимо этанола образуются дрожжи, фурфурол, лигнин и лигниносульфонаты, гипс. Во всех вариантах биохимического метода производства этанола выделяется оксид углерода (IV). В настоящее время синтетический этанол получают исключительно прямой гидратацией этилена. Метод сернокислотной гидратации сохранил значение только для производства изопропанола и бутанолов вследствие низкой экономичности процесса. Производство этанола прямой гидратацией этилена Этилен как сырье в этом методе производства этанола может быть выделен из пирогаза, полученного пиролизом низкооктанового бензина, из газов нефтепереработки или попутного газа, из этиленовой фракции обратного коксового газа (ОКГ), а также получен пиролизом этана (Схема 2).
Основную массу этилена в настоящее время получают пиролизом нефтяного сырья, преимущественно бензина. Физико-химические основы прямой гидратации этилена; Из уравнения реакции следует, что равновесный выход этанола зависит от условий гидратации и растет с понижением температуры, повышением давления и увеличением мольного отношения воды и этилена. Процесс гидратации катализируется кислыми и нейтральными катализаторами, среди которых наибольшее применение получила фосфорная кислота на носителе в виде кизельгура или силикагеля. В присутствии фосфорной Кислоты происходит электрофилыюе присоединение воды к этилену по схеме:
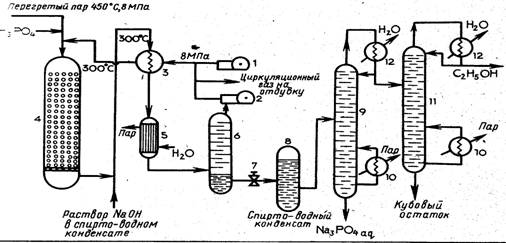
Катализ осуществляется свободной фосфорной кислотой, которая в жидком состоянии находится на поверхности зерен носителя. Таким образом, активность катализатора зависит от концентрации кислоты. При концентрации кислоты ниже. 83% активность катализатора резко падает. В свою очередь, концентрация кислоты зависит от парциального давления паров воды в системе и температуры. Поэтому, вопреки, требованиям термодинамики данного процесса, его нельзя вести при большом мольном отношении воды (пара) и, этилена, так как это снижает концентрацию кислоты, а следовательно, и активность катализатора. На практике это отношение' поддерживают в пределах (0,6-0,7):1. Время работы катализатора — около 500 ч, после чего его активность падает, так как часть кислоты уносится током продуктов. Это вызывает необходимость непрерывного добавления фосфорной кислоты в процессе работы установки. При соблюдении этого условия и применении в качестве сырья газа с высоким содержанием этилена интенсивность катализатора составляет 180—200 кг этанола с 1 м3 катализатора в час. В качестве побочных продуктов при гидратации этилена образуются ацетальдегид, диэтиловый эфир и различные олигомеры. Технологическая схема прямой гидратации этилена. В промышленности процесс гидратации может осуществляться- в двух вариантах: в жидкой и паровой фазах. На практике реализован, преимущественно второй вариант. В этом случае процесс ведут при температуре 290 °С и давлении 8 МПа, что позволяет обеспечить степень конверсии этилена за один проход до 6% при выходе этанола по этилену около 95 %. Технологический процесс получения этанола прямой гидратацией этилена в паровой фазе строится по циклической схеме. В ней', предусмотрены приготовление, парогазовой смеси (этилен и водяной пар), пополнение потерь катализатора, нейтрализация уносимой с газовым потоком фосфорной кислоты, периодическая отдувка циркуляционного газа для удаления из него примесей и рациональный теплообмен с использованием теплоты реакции гидратации. Парогазовую смесь готовят совместным нагреванием паров воды и этилена в теплообменниках и трубчатой печи или смешением этилена с перегретым паром высокого давления. В промышленном масштабе реализованы обе схемы, однако вторая, используемая в нашей' стране, экономически целесообразна при наличии ТЭЦ вблизи производства этанола, В последнее время для приготовления парогазовой смеси вместо пара высокого давления рекомендуют использовать рецикловую воду и паровой конденсат. На рис. 1 приведена схема гидратации этилена в паровой фазе. Вводимый этилен сжимают в компрессоре 1до 8 МПа и смешивают с циркуляционным газом. Так как давление циркуляционного газа ниже, чем этилена (объем газа уменьшился за счет образования этанола), его дополнительно сжимают в компрессоре 2. Смесь свежего этилена с циркуляционным, газом подогревают до 300 °С в теплообменнике 3 продуктами реакции и смешивают с перегретым да 450 °С паром при давлении 8 МПа. Парогазовая смесь поступает в гидрататор 4. Гидрататор выполнен в виде реактора идеального вытеснения ~ (РИВ-Н) представляет собой стальной цилиндр диаметром 1,5 м и высотой 10 м; футерованный изнутри медью и наполненный катализатором, насыпанным на перфорированный конус
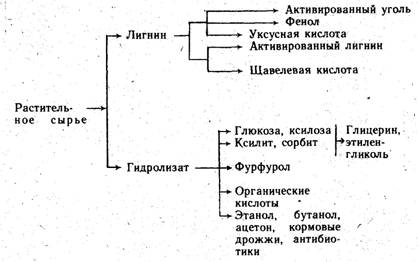
Рис. 1. Схема гидратации этилена в паровой фазе: 1 — компрессор этилена; 2 — компрессор циркуляционного; 3 — теплообменник; 4—гидрататор; 5—котел-утилизатор На выходе из гидрататора смесь этанола, водяного пара и непрореагировавшего этилена обрабатывают водным раствором гидроксида натрия для нейтрализации унесенной потоком фосфорной кислоты, охлаждают в теплообменнике 3 и направляют в котел-утилизатор 5, в котором вырабатывается пар низкого давления, поступающий затем в пароперегреватель. Из котла-утилизатора продукты поступают в сепаратор (газоотделитель) высокого давления 6. Здесь отделяется циркуляционный газ, направляемый в компрессор 2, а спирто-водный конденсат с содержанием этанола до 15 % дросселируют через редукционный вентиль 7 до давления 0,5—0,6 МПа и направляют в сепаратор (сборник) низкого давления 8. В сборнике за счет снижения давления выделяется растворенный в конденсате этилен, который добавляют к циркуляционному газу. Из сепаратора-сборника 8 спирто-водный конденсат поступает в отпарную ректификационную колонну 9. Здесь за счет нагревания жидкости паром через кипятильник 10 и ректификации смеси происходит отделение паров этанола, загрязненных примесями, от водного раствора фосфата натрия. Из колонны 9 этанол направляют в ректификационную колонну. После ректификации получают очищенный этанол-ректификат, содержащий ацетальдегид (до 2 %) и диэтиловый эфир (не более 1 %). Последующая очистка синтетического этанола и требования к нему зависят от области использования этанола. Производительность современных установок прямой гидратации этилена достигает 30 тыс. тонн этанола в год. Производство этанола гидролизом древесины Гидролизное производство. Производство этанола из древесного сырья представляет собой частный случай гидролизного производства, т. е. производства, основанного на химической переработке растительных материалов путем каталитического превращения содержащихся в них полисахаридов в моносахариды. При этом непищевое растительное сырье (отходы древесины, подсолнечная лузга, кукурузные кочерыжки и др.) может быть превращено в пищевые, кормовые и технические продукты. Из образующихся в результате гидролиза этих полисахаридов водных растворов моносахаридов (гидролизатов) кристаллизацией получают пищевую глюкозу и техническую ксилозу; гидрированием — ксилит и сорбит; дегидратацией — фурфурол; окислением — органические кислоты; микробиологической переработкой — этанол, бутанол, ацетон, кормовые дрожжи, антибиотики. Из лигнина, остающегося после отделения гидролизата, термической обработкой получают активированный уголь, уксусную кислоту и фенол; химической переработкой — активированный лигнин и щавелевую кислоту; прессованием — строительные материалы. Процесс гидролиза растительных материалов, как пример малоотходного производства, представлен на схеме 3.
В зависимости от природы целевых продуктов гидролизное производство строится по той или иной технологической схеме. При этом, если в качестве сырья используют древесные отходы, то из 1 т абсолютно сухой древесины может быть получено 220 кг кормовых дрожжей, или 35 кг дрожжей и 175 л этанола, или 110 кг дрожжей и 80 кг фурфурола. Физико-химические основы производства гидролизного этанола. Наиболее распространенное сырье для производства гидролизного этанола — древесина — представляет собой сложную систему, состоящую из целлюлозы, гемицеллюлоз, лигнина, а также небольших количеств смол, эфирных масел, дубильных и красящих веществ. Элементный состав органической части древесины практически постоянен: углерод — 49—51 %, Водород — 6,1—6,9 %, кислород — 43—45 %, азот — 1 %. В то же время содержание целлюлозы, лигнина и гемицеллюлоз зависит от природы древесины. В среднем в сухой древесине хвойных пород, используемой для производства этанола, содержится 52—58 % целлюлозы, 28—29 % лигнина и около 20 % гемицеллюлоз. Гемицеллюлозы — это олигомеры различной степени нолимеризации, состоящие из пентозанов и гексозанов (С6Н1005)п. Пентозаны построены из остатков, моносахаридов ксилозы и арабинозы, гексозаны — из остатков моносахаридов маннозы, галактозы, фруктозы и глюкозы. Страницы: 1, 2 |
Copyright © 2012 г.
При использовании материалов - ссылка на сайт обязательна.