ГЛАВА 84. ЛАПАРОСКОПИЧЕСКАЯ ХИРУРГИЯ
1. Что такое малоинвазивная хирургия?
Очень немногие достижения
способны привести к изменению современной хирургии более значительно и
быстро, чем это сделала лапароскопическая холецистэктомия. Впервые выполненная
в 1985 г. во Франции лапароскопическая лазерная холецистэктомия была внедрена
в США в 1988 г. Дальнейшие попытки внедрять малоинвазивный подход к выполнению
самых различных операций беспрецедентны в истории развития хирургии по
своей интенсивности и скорости.
Кроме лапароскопической
хирургии, увеличивающееся число других малоинвазив-ных операций, видеоэндоскопических
вмешательств или малоинвазивных оперативных вмешательств, при которых хирурги
применяют альтернативные доступы к внутренним органам, можно объединить
под одним термином малоинвазивная хирургия. Данный термин лучше
всего отражает суть перечисленных оперативных вмешательств. Следуя интересам
пациентов (сведение до минимума травматичности операции) и под давлением
различных социально-экономических факторов (необходимость уменьшать длительность
пребывания пациентов в стационаре и быстрее возвращать их к нормальной
жизни и работе), достижения в современной хирургии и современных технологиях
дали рождение новой эре в хирургии — эре малоинвазив-ной хирургии. Современные
диагностические методики, способы определения стадий опухолей, оперативная
техника, в том числе выполнение восстановительных операций, которые значительно
уменьшают психическое, биохимическое и психологическое воздействие на пациента,
принципиально изменили современную хирургию.
2. Каковы преимущества
и недостатки малоинвазивной хирургии?
|
ПРЕИМУЩЕСТВА
|
НЕДОСТАТКИ
|
|
Лучший обзор
операционного поля Снижение болей и стресса в послеоперационном периоде
Более хорошие косметические результаты Снижение длительности пребывания
пациентов в стационаре, снижение общей стоимости лечения Более ранний возврат
к нормальной жизнедеятельности, социально-экономические преимущества Минимальное
воздействие на иммунную систему
|
Двухмерное
изображение трехмерного операционного поля Невозможность пальпации тканей
Увеличение длительности операции, повышение стоимости оборудования операционного
зала Проблемы с удалением (ново)образования Высокотехнологичное окружение
(включая лабораторные исследования и видеоаппаратуру) Необходимость в приобретении
специальных навыков работы с видеоэндоскопическим оборудованием
|
3. Сколько лапароскопических
холецистэктомий ежегодно выполняется в США?
Ежегодно в США выполняется
приблизительно 600 000 лапароскопических холецистэктомий.
4. Повысились ли требования
к холецистэктомий с внедрением в клиническую практику лапароскопической
техники?
В ходе ретроспективного исследования
с использованием данных страховых компаний сравнивалась частота выполнения
холецистэктомий до и после внедрения в клиническую практику лапароскопической
техники. В 1988 г. частота проведения холе-цистэктомии составила 1,35 на
1000 человек, а в 1992 т. — 2,15 на 1000 человек (увеличилась на
59 %). Преимущества от снижения стоимости стационарного лечения при выполнении
лапароскопических холецистэктомий несколько нивелировались повышением требований
в целом к хирургии желчевыводящих путей и повышением общей стоимости такой
хирургии на 11,4 %. При анализе работы медицинских центров, оказывающих
неотложную хирургическую помощь в штате Мэриленд, была обнаружена аналогичная
динамика - частота выполнения холецистэктомий с 1,65 на 1000 человек в
1985 г. возросла до 2,17 в 1992 г. (увеличилась на 32 %). Введение в клиническую
практику лапароскопической холецистэктомий снизило длительность и общую
стоимость стационарного лечения, но увеличило финансовые расходы, первоначально
предусматриваемые для приобретения оборудования.
5. Перечислите преимущества
и недостатки использования углекислого газа для наложения пневмоперитонеума.
Использование углекислого газа для
наложения пневмоперитонеума
|
ПРЕИМУЩЕСТВА
|
НЕДОСТАТКИ
|
|
Углекислый
газ препятствует возгоранию и поэтому считается идеальным газом для выполнения
лапароскопических операций
|
Углекислый
газ легко всасывается и, таким образом, может повышать Рсо2
артериальной крови и понижать рН, что приводит к развитию соответствующих
метаболических и гемодинамических нарушений у некоторых пациентов
|
|
Углекислый
газ имеет высокий коэффициент диффузии, что снижает риск развития газовой
эмболии. В эксперименте до 100 мл/мин углекислого газа может быть введено
в крово ток животных без тяжелых последствий
|
Инсуффляция
холодного углекислого газа, особенно при быстром его введении или длительной
операции, может привести к развитию гипотермии
|
|
Углекислый
газ безопасно всасывается и может быть эффективно удален легкими при умеренной
гипервентиляции
|
Были опубликованы
случаи развития напряженного СО2-пневмоторакса, возникшие либо
вследствие скрытых повреждений диафрагмы, либо при повреждении диафрагмы
во время операции (чаще всего при выполнении манипуляций в области пищеводного
отверстия диафрагмы)
|
|
Углекислый
газ является недорогим и легкодоступным
|
Может развиваться
СО2-эмболия, даже если углекислый газ не вводится случайно в
брыжеечные вены
|
6. Можно ли для выполнения
лапароскопических операций использовать какие-либо другие газы?
Да, можно. Для наложения
пневмоперитонеума используются воздух операционного зала, кислород, закись
азота, гелий и углекислый газ, однако чаще всего применяется последний.
В настоящее время продолжается поиск новых газов для наложения пневмоперитонеума.
Одним из наиболее многообещающих газов является гелий. В эксперименте на
животных показано, что при создании пневмоперитонеума инсуффляция гелия
приводит к меньшей задержке газа в артериальной крови, чем при инсуффляции
углекислого газа.
7. К каким последствиям
со стороны дыхательной и сердечно-сосудистой системы приводит наложение
пневмоперитонеума (повышение внутрибрюшного давления)?
Действие повышенного внутрибрюшного
давления на дыхательную систему. Пнев-моперитонеум изменяет механику
дыхания. Увеличение внутрибрюшного давления приводит к повышению уровня
стояния диафрагмы, снижению функциональной остаточной емкости легких, снижению
общего объема легочной вентиляции, нарушению коэффициента "вентиляция/перфузия"
и развитию ателектазов. Для коррекции возникающих дыхательных нарушений
некоторым пациентам требуется искусственная вентиляция легких под повышенным
давлением. У здоровых пациентов при наложении пневмоперитонеума не наблюдается
каких-либо выраженных изменений оксигенации артериальной крови, однако
у пациентов с какими-либо сердечно-легочными нарушениями отмечаются признаки
нарушения насыщения артериальной крови кислородом, вероятнее всего, вследствие
механических нарушений вентиляции.
Действие повышенного
внутрибрюшного давления на гемодинамические показатели. При наложении
пневмоперитонеума во время выполнения лапароскопических операций (напряжение
пневмоперитонеума составляет в среднем 12-15 мм рт. ст.) повышаются среднее
артериальное давление и системное периферическое сопротивление (на 35 %
и 160 % соответственно). Это происходит вследствие симпатической вазоконстрикции,
развивающейся в ответ на гиперкапнию. Сердечный индекс может уменьшаться
на 20 %. Как только внутрибрюшное давление становится выше 20 мм рт. ст.,
снижается сердечный выброс, нарушается венозное сопротивление в сосудах
живота, повышается эффективное сопротивление в нижней полой вене, снижается
венозный возврат и развивается гипотензия. Увеличивать эти нарушения, особенно
у пациентов с сердечно-сосудистыми и легочными заболеваниями, может повышение
внутрибрюшного давления или перевод пациента в положение Тренделенбурга
(Trendelenburg). Венозный кровоток в системе воротной вены снижается на
70 %, когда внутрибрюшное давление достигает 25 мм рт. ст. Во многих работах
высказано предположение, хотя оно окончательно и не подтверждено экспериментально,
что при наложении пневмоперитонеума и повышении внутрибрюшного давления
до 12-15 мм рт. ст. наблюдается снижение почечного кровотока, а следовательно,
и клубочковой фильтрации.
В заключение следует еще
раз подчеркнуть, что повышение внутрибрюшного давления до 15 мм рт. ст.
может приводить к значительным изменениям центральной гемо-динамики и еще
более выраженным изменениям кровотока внутренних органов.
8. До какого уровня можно
безопасно повышать внутрибрюшное давление при наложении пневмоперитонеума?
Вследствие возможного развития
осложнений со стороны сердечно-сосудистой и дыхательной систем максимальное
внутрибрюшное давление, которое можно создавать при наложении пневмоперитонеума,
составляет 15 мм рт. ст.
9. Каковы существующие
в настоящее время противопоказания к выполнению лапароскопических
операций?
Критерии отбора пациентов
для лапароскопических операций изменились за последние 5-6 лет. Основой
для безопасного отбора пациентов является уровень квалификации (практических
навыков) хирурга. Технические сложности при проведении лапароскопических
операций иногда требуют перехода на традиционную открытую операцию. Решение
о переходе с лапароскопической на традиционную открытую операцию должно
быть продиктовано не амбициями хирурга, а исключительно интересами и безопасностью
пациента.
Список противопоказаний
к лапароскопическим операциям за последние годы неуклонно уменьшается.
В настоящее время единственным абсолютным противопоказанием к выполнению
лапароскопических операций является некорригируемая коагу-лопатия. К другим
состояниям или заболеваниям пациентов, также требующим особого внимания
хирургов, относятся:
Непереносимость общей анестезии.
Разлитой перитонит.
Патологическая тучность
пациентов.
Карцинома.
Хрупкие (легко повреждаемые)
ткани желчного пузыря.
Цирроз печени.
Предшествующие операции
на органах брюшной полости.
Беременность.
Кишечная непроходимость.
Острое и хроническое воспаление.
Небольшие нарушения системы
свертывания крови.
Наличие водителя сердечного
ритма.
Вентрикулоперитонеальный
шунт.
Кроме того, всех пациентов,
которым планируется выполнение лапароскопической операции, необходимо тщательно
обследовать и провести у них оценку сопутствующих заболеваний, которые
могли бы каким-либо образом повлиять на оперативный доступ. Риск операции
не уменьшается автоматически только потому, что она выполняется с помощью
малоинвазивной техники.
10. Худой женщине в возрасте
68 лет с хроническим обструктивным заболеванием легких, которая курила
в течение 52 лет, планируется выполнение лапароскопической холецистэктомии
по поводу острого холецистита. Вследствие того, что у нее имеется рубец
после нижнесрединной лапаротомии, вы выбрали "открытый" способ (способ
Хассона, Hasson) для введения первого троакара и поэтому у вас не было
никаких проблем при доступе в брюшную полость, вы сразу начинаете накладывать
пневмоперитонеум, вводя газ в брюшную полость со скоростью 10 л/мин. После
повышения внутрибрюшного давления до 12 мм рт. ст. вы начинаете выполнение
собственно лапароскопической холецистэктомии. Через 15 мин анестезиолог
обнаруживает, что у пациентки повышается концентрация углекислого газа
в выдыхаемом воздухе (ЕТСО2) и принимает решение исследовать
газы артериальной крови. Прежде чем анестезиолог получает результаты исследования
из лаборатории, у пациентки возникают несколько эпизодов желудочковой тахикардии
и остановка сердца. Какие патофизиологические изменения стоят за всеми
этими событиями?
Введенный в брюшную полость
углекислый газ непосредственно всасывается через брюшину в капиллярное
русло и затем в системный кровоток. Обычно Рсо2 и ЕТСО2 повышаются
незначительно, но могут возникать ситуации, когда происходит выраженное
(можно сказать, катастрофическое) повышение Рсо2, сопровождающееся
значительным падением рН с развитием ацидемии (ацидоза), что в свою очередь
приводит к обострению существующих заболеваний сердца. У большинства пациентов
происходит адаптация к всасыванию углекислого газа посредством увеличения
плазменного объема и активизации внутриклеточных буферных систем, ускоряющих
транспорт углекислого газа и удаление его из организма при легкой гипервентиляции.
Однако у некоторых пациентов механизмы удаления углекислого газа нарушаются.
Не в состоянии компенсировать острые изменения Рсо2 пациенты
с повышенным метаболизмом и нарушением клеточного дыхания (например, при
септическом состоянии), с большим "мертвым" дыхательным пространством (например,
пациенты с хроническими обструктивными заболеваниями легких) и с недостаточным
сердечным выбросом (например пациенты с пороками сердца).
Во время выполнения лапароскопических
операций необходимо соблюдать особую осторожность и осуществлять специальный
динамический контроль для предотвращения значительной гиперкапнии и ацидемии
(ацидоза). Следует избегать быстрых изменений внутрибрюшного давления (сопровождаются
изменением абсорбционных градиентов углекислого газа), которые возникают
при очень большой начальной скорости инсуффляции углекислого газа, что
в свою очередь приводит к резкому увеличению градиента между внутрибрюшным
давлением углекислого газа и Рсо2. Равновесие между давлением
углекислого газа в крови и в тканях наступает приблизительно в течение
20 мин. Сразу после начала инсуффляции в брюшную полость углекислого газа,
Рсо2 артериальной крови равномерно повышается и затем удерживается
на постоянном уровне.
В рассматриваемом случае
пациентке с хроническими обструктивными заболеваниями легких была выполнена
быстрая инсуффляция в брюшную полость углекислого газа, что привело к гиперкапнии,
пик которой наступил через 15-20 мин после начала введения углекислого
газа, с последующим развитием ацидоза, который является пусковым моментом
для раздражения желудочков и остановки сердца.
11. Увеличивается ли риск
развития тромбоза глубоких вен нижних конечностей и, следовательно, риск
возникновения тромбоэмболии легочной артерии у пациентов, которым выполняются
лапароскопические операции на органах верхних отделов живота? Есть ли необходимость
после лапароскопических операций проводить профилактику развития тромбоэмболических
осложнений?
Хирурги предполагают, что
некоторые факторы, которые возникают во время выполнения лапароскопических
операций на органах верхних отделов брюшной полости, должны повышать частоту
возникновения тромбоза глубоких вен, и, следовательно, увеличивать риск
развития тромбоэмболии легочной артерии. Положение, обратное положению
Тренделенбурга, модифицированное литотомическое положение, длительное время
проведения операции и повышение внутрибрюшного давления способствуют снижению
венозного возврата с развитием застоя крови в нижних конечностях. Имеющиеся
в настоящее время данные свидетельствуют о том, что частота возникновения
тромбоэмболии легочной артерии при выполнении лапароскопических холецистэктомии
не увеличивается. Однако Биби (Beebe), проводя двойное сканирование и прямое
измерение давления в правой бедренной вене до и после инсуффляции газа
в брюшную полость, обнаружил, что после инсуффляции газа венозное давление
в бедренной вене повышается, а скорость тока крови замедляется без изменения
поперечного сечения сосудов. Инсуффляция газа также приводила к исчезновению
венозной пульсации у 75 % пациентов. Все эти изменения приходили к норме
после удаления газа из брюшной полости.
Хотя при проведении исследований
и не обнаружено собственно тромбоза глубоких вен, полученные результаты
свидетельствуют в пользу того, что риск возникновения такого тромбоза при
выполнении лапароскопических операций увеличивается. Группа исследователей
под руководством Вильсона (Wilson) впоследствии продемонстрировала, что
пневмоперитонеум создает сопротивление венозному возврату. Достаточно эффективным
способом восстановления венозного возврата является использование во время
операции компрессионных чулок. Пациентам, которым выполняются общехирургические
лапароскопические вмешательства, рекомендуется всегда проводить профилактику
тромбоэмболических осложнений либо с помощью специальных пневматических
чулок, создающих последовательное сжатие, либо с помощью подкожного введения
гепарина.
12. Кто предложил применять
в медицине электрокоагуляцию? Почему для этой цели обычно используется
переменный ток?
Во всем мире в большинстве
операционных для выполнения различных электрохирургических манипуляций
используются аппараты, которые носят название "Bovie". Такое название эти
аппараты получили в честь Уильяма Бови (William Bovie) и Харви Кушинга
(Harvey
Сushing), предложивших в 1929 г. использовать электрокоагуляцию в медицине.
В США в быту используется переменный ток с частотой 60 Гц. Однако в операционных
или в электрохирургических приборах, применяемых в эндоскопии, применяется
переменный ток с частотой от 400 000 до 2 000 000 Гц. При использовании
такого высокочастотного электрического тока не возникает нервно-мышечной
стимуляции. Ток с более низкой частотой, как, например, стандартный ток
с частотой 60 Гц, может вызывать тетанию и смерть от удара током.
Принцип работы всех приборов
для электрокоагуляции состоит в создании высокой температуры на клеточном
уровне. Когда электрокоагулятор работает в режиме резания, электрический
ток находится в активном режиме все время, но напряжение его ниже (примерно
100 В). При работе электрокоагулятора в режиме коагуляции напряжение
тока выше (примерно 600 В), но в активном режиме он находится только 5-10
% времени, остальные 90 % времени ток выключен. На практике, как правило,
применяются различные варианты объединения режимов резания и коагуляции.
При этом напряжение тока создается ниже, чем в режиме коагуляции (но выше,
чем в режиме резания), но длительность нахождения его в активном режиме
меняется таким образом, что достигается оптимальный эффект.
Точные механизмы действия
электрокоагуляции пока еще не известны. Электрокоагулятор в режиме резания
генерирует непрерывный ток с перемещением ионов внутри клетки, приводя
к ее испарению. Высвобождение содержимого разрушенной (испаряющейся, или
кипящей) клетки рассеивает (поглощает) тепло, уменьшая таким образом повреждение
соседних тканей. В режиме коагуляции при более высоком напряжении, но при
кратковременном действии тока клетка погибает, но не испаряется. "Высушивающий"
эффект во время работы прибора в активном режиме приводит к высыханию клеток,
создавая таким образом область увеличенного сопротивления прохождению электронов,
в результате чего выделяется еще больше тепла и происходит повреждение
более глубоких слоев тканей. Этот эффект частично может быть объяснен формулой
р = I2 X R, где мощность (р, или относительная теплота, выделяющаяся
в единицу времени) равна силе тока (I) в квадрате, проходящего через некоторое
сопротивление тканей (R). В действительности этот эффект более сложен,
чем выражает эта простая формула, поскольку различные ткани организма имеют
различные уровни проводимости и сопротивления. Это объясняет тот факт,
почему при одной и той же интенсивности электрокоагуляции некоторые ткани
повреждаются значительно, а другие не повреждаются совсем.
13. Повышается ли во время
выполнения лапароскопической операции вероятность возникновения скрытого
желудочно-пищеводного рефлюкса, и, следовательно, риск развития аспирационной
пневмонии?
Раньше считалось, что положение
Тренделенбурга в сочетании с повышением внутри-брюшного давления при наложении
пневмоперитонеума во время выполнения лапа-роскопических операций предрасполагает
к возникновению "скрытого" желудочно-пищеводного рефлюкса. Однако при непрерывном
измерении рН содержимого пищевода, выполненном во время лапароскопической
холецистэктомии, не было выявлено признаков желудочно-пищеводного рефлюкса.
Хэйливи (Halevy) исследовал 14 пациентов, измеряя рН содержимого пищевода
во время лапароскопической холецистэктомии. Только у 2 пациентов был выявлен
одиночный кратковременный эпизод желудочно-пищеводного рефлюкса (продолжительностью
0,1 мин и рН 3,3 в одном и 3,7 в другом случае). Линд (Lind) первый отметил,
что повышение внутрибрюшного давления приводит к увеличению давления в
области нижнего пищеводного сфинктера. Кроме того, Джонс (Jones) и соавт.
обнаружили точно такой же эффект во время лапароско-пических операций.
При проведении этих исследований установлено, что при повышении внутрибрюшного
давления в процессе выполнения лапароскопических операций нет опасности
возникновения желудочно-пищеводного рефлюкса. Тем не менее эмпирические
исследования показали, что частота развития клинически значимого желудочно-пищеводного
рефлюкса во время плановых лапароскопических операций составляет от 0,002
до 2 % и до 20 % во время экстренных лапароскопических операций. К факторам
риска развития желудочно-пищеводного рефлюкса во время выполнения лапароскопической
операции относятся ожирение, беременность, сахарный диабет, парез желудка,
аэрофагия, положение Тренделенбурга и грыжи пищеводного отверстия диафрагмы.
Профилактические мероприятия, которые необходимо использовать для уменьшения
вероятности возникновения желудочно-пищеводного рефлюкса в процессе лапароскопической
операции, должны включать введение прокинетических препаратов (например
метоклопрамид по 10 мг перорально или внутривенно), блокаторов Н2-рецепторов
гистамина (например циметидин или ранитидин) и декомпрессию желудка желудочным
зондом.
14. Патологическое ожирение,
определяемое как превышение идеальной массы тела более чем на 100 фунтов
(или приблизительно на 45,5 кг), в настоящее время не является больше противопоказанием
к выполнению лапароскопической холецистэктомии, однако для достижения успешного
исхода операции необходимо соблюдать определенные особые условия. Опишите
технические особенности выполнения лапароскопической холецистэктомии у
пациентов с патологическим ожирением.
Безопасный доступ и адекватная
визуализация анатомических структур в области ворот печени являются главными
условиями выполнения успешной лапароскопической холецистэктомии у пациентов,
страдающих избыточным ожирением. Для этого прежде всего необходимо правильно
выбрать оптимальное место введения троакара для видеокамеры. У пациентов
с нормальной массой тела этот троакар вводится на уровне пупка. У пациентов,
страдающих ожирением, особенно у пациентов высокого роста, введение этого
троакара на 1 -5 дюймов (2,5-12,5 см) в краниальном направлении от пупка
позволяет получать оптимальный обзор анатомических образований ворот печени
при использовании лапароскопа с торцевой оптикой. При введении лапароскопа
с видеокамерой через пупочный троакар обзор ворот печени часто может перекрываться
петлями кишки или жировой клетчаткой передней брюшной стенки, которую крайне
сложно бывает приподнять при инсуффляции в брюшную полость газа. Некоторые
хирурги предпочитают получать доступ в брюшную полость у пациентов, страдающих
ожирением, с использованием "закрытого" способа с помощью введения иглы
Вереша (Verress) через пупок, с последующим введением более длинного троакара
через небольшой разрез кожи выше пупка. У пациентов с избыточным ожирением
достаточно часто газ нагнетается в предбрюшинную клетчатку, поскольку даже
при механическом подъеме передней брюшной стенки задний листок поперечной
фасции часто не приподнимается. Мы предпочитаем "открытый" доступ Хассона
с надпупочным введением троакара.
Другая методика, позволяющая
улучшить обзор области ворот печени у пациентов, страдающих ожирением,
включает использование лапароскопа с углом наклона оптики в 30°. При этом
нет необходимости в надпупочном введении троакара. При использовании боковых
троакаров необходимо соблюдать особую осторожность, поскольку их иногда
можно ввести не в брюшную полость, а в предбрюшинную клетчатку.
Для облегчения ретракции
органов и улучшения обзора иногда возникает необходимость в введении пятого
5-миллиметрового троакара в правом подреберье либо медиально, либо латерально.
Некоторые хирурги используют для смещения вниз двенадцатиперстной и поперечной
ободочной кишки 5-миллиметровый ретрактор в виде веера. Однако при применении
такого ретрактора следует соблюдать крайнюю осторожность, особенно если
он не попадает в постоянный обзор видеокамеры, с тем чтобы не повредить
им внутренние органы.
Продолжительность лапароскопической
холецистэктомии у пациентов, страдающих ожирением, больше, чем у пациентов
с нормальной массой тела. При этом у пациентов, страдающих ожирением, не
было отмечено повышения ни частоты перехода на открытую операцию, ни частоты
развития осложнений. Лапароскопическая холецистэктомия стала операцией
выбора для пациентов с желчнокаменной болезнью, страдающих ожирением, хотя
для этого требуются и некоторые специальные инструменты, и особый опыт
хирурга.
15. Какие существуют патофизиологические
особенности течения острого холецистита, которые увеличивают вероятность
возникновения во время операции технических трудностей. Что необходимо
предпринимать хирургу для преодоления этих проблем?
Частота перехода на традиционную
открытую операцию у пациентов с острым холециститом приблизительно в 2-4
раза выше, чем при выполнении плановых операций по поводу хронического
холецистита. Даже у опытных хирургов, использующих специальное оборудование
и технику операции, эта частота обычно составляет 3-5 %. Прежде всего у
пациентов с острым холециститом большую проблему вызывает перерастянутый,
воспаленный желчный пузырь с толстыми стенками. В таких случаях для облегчения
захвата стенки перерастянутого желчного пузыря граспером необходимо выполнить
его декомпрессию либо с помощью специального троакара, либо даже чрескожно
(под непосредственным визуальным контролем) с помощью центрального венозного
катетера. Стенку желчного пузыря можно захватывать также и травма-тичным
(зубчатым) зажимом, но поскольку в таких случаях может возникнуть перфорация
стенки желчного пузыря, то во избежание подтекания желчи в брюшную полость
зажим этот после наложения не следует снимать до конца операции. Если имеется
подтекание желчи либо из места пункции пузыря при его чрескожном дренировании,
либо из разрыва стенки в месте захвата ее травматичным граспером, то необходимо
на этот дефект стенки желчного пузыря наложить швы или петлевую лигатуру.
Иногда при интенсивных воспалительных изменениях стенки желчного пузыря
ее так и не удается захватить обычным граспером. В таких случаях, для того
чтобы захватить и осуществлять ретракцию желчного пузыря, можно использовать
выпускаемые промышленностью инструменты в виде штопора или шурупа типа
винта Реддика (Reddick).
Несмотря на все усилия,
даже у опытных хирургов подтекание в брюшную полость желчи во время выполнения
лапароскопической холецистэктомии отмечается в SO-SO %. Для удаления из
брюшной полости воспаленного и разрушенного желчного пузыря, выпавших из
пузыря желчных камней, а также различных некротизированных тканей необходимо
использовать специальные стерильные пакеты. Дренажи после лапароскопической
холецистэктомии необходимо устанавливать, руководствуясь принципами, которые
применяются в открытой традиционной хирургии. Другой проблемой, возникающей
перед хирургом во время выполнения лапароскопической холецистэктомии по
поводу острого холецистита, является выделение и клиппирование пузырного
протока и пузырной артерии. Не всегда удается использовать клиппатор на
воспаленных тканях. Кроме того, наложенные на воспаленные ткани скобки
могут не выполнять своих функций и легко соскальзывать в дальнейшем. В
таких случаях необходимо для перевязки пузырного протока и пузырной артерии
использовать лигатуры.
16. Каковы ключевые принципы
проведения безопасной препаровки тканей в области ворот печени?
Ключевые принципы проведения безопасной
препаровки тканей в области ворот печени
1. Препаровку тканей необходимо проводить
по направлению от шейки желчного пузыря вниз к пузырному протоку.
2. Препаровку тканей надо осуществлять
с латерального направления к медиальному.
3. Необходимо проводить адекватную
тракцию желчного пузыря в латеральном направлении для хорошего обзора треугольника
Кало (Calot).
4. Препаровку тканей как с медиальной,
так и с латеральной стороны желчного пузыря следует проводить от шейки
пузыря к пузырному протоку.
5. Никогда не пересекайте никаких
тканей и анатомических структур, пока не убедитесь, что это такое.
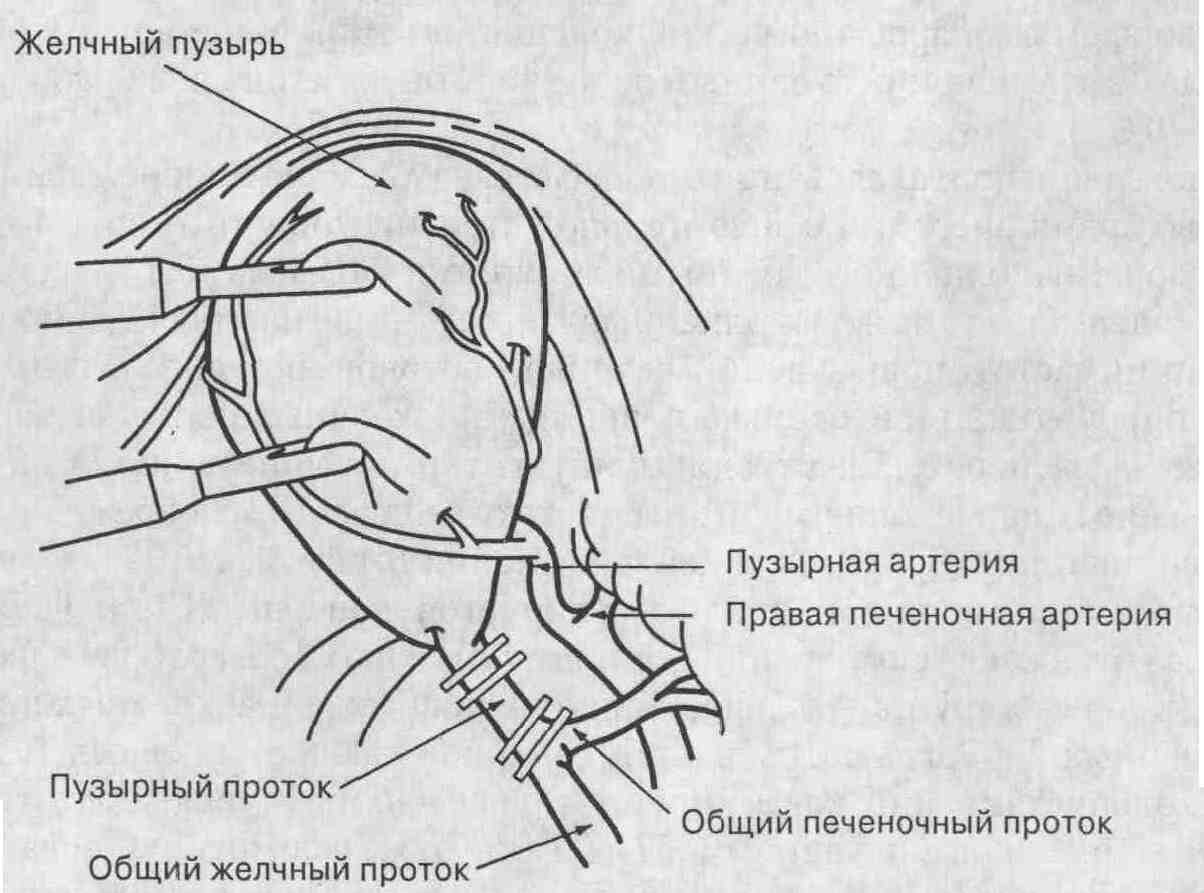
Схематичное изображение анатомических
нарушений желчного пузыря и желчных протоков во время лапароскопической
холецистэктомии.
Эсновной потенциальной опасностью
при выполнении лапароскопической холецистэктомии является повреждение желчных
протоков. При наличии острого воспаления пузырный проток может быть укорочен,
анатомия этой области искажена, могут вовсе отсутствовать различные анатомические
ориентиры в области ворот печени, что в значительной степени затрудняет
препаровку тканей с помощью лапароскопической техники (см. рисунок). Соответственно,
для более уверенного ориентирования в нарушенной анатомии желчных протоков
в таких ситуациях лучше выполнять интраоперационную холангиографию. Если
при этом ни лапароскопическая препа-ровка тканей, ни интраоперационная
холангиография не позволяют полностью разобраться в анатомии желчных протоков,
то для безопасности пациента следует переходить на открытую, традиционную
холецистэктомию. Лапароскопическая холецистэктомия, выполняемая по поводу
острого холецистита, сопровождается вполне умеренной частотой перехода
на открытую операцию (как правило, эта цифра не превышает 8 %), укорачивает
длительность пребывания пациентов в стационаре и способствует более быстрому
возвращению их к нормальной жизни и профессиональной деятельности.
17. Какова частота повреждения
желчных протоков во время открытой и лапароскопической холецистэктомии?
Когда чаще всего встречаются повреждения желчных протоков?
Повреждения крупных желчных
протоков всегда находятся в центре внимания лапароскопических хирургов,
поскольку эти осложнения, как правило, бывают очень серьезными, а также,
о чем свидетельствует первый опыт выполнения эндоскопических операций,
потому что они чаще возникают во время лапароскопических, чем во время
традиционных холецистэктомии. По данным современного исследования, охватывающего
достаточно большую группу открытых холецистэктомии, частота повреждений
желчных протоков колеблется от 0,1 до 0,4 %. Частота повреждения желчных
протоков во время лапароскопической холецистэктомии изменяется в более
широких пределах, и составляет, по данным более 90 % опубликованных работ,
приблизительно 0,1-0,6 %.
Во всех проведенных исследованиях
отмечается, что частота повреждений желчных протоков во время операции
в значительной степени зависит от опыта хирурга. По данным обзора, выполненного
военными хирургами США, из 99,4 % всех лапароскопических холецистэктомии,
выполненных во всем мире, начиная с самого освоения этой операции, частота
повреждений желчных протоков составила всего 0,57 %. Причем в эту цифру
вошли и несколько повреждений желчных протоков, которые произошли уже после
перехода
на традиционную открытую операцию. А при выполнении собственно лапароскопической
холецистэктомии частота повреждений желчных протоков составила 0,48 %.
Заслуживает внимания тот факт, что 92,5 % всех повреждений желчных протоков
приходились у хирургов на первые 10 их операций. Этот факт как раз отражает
точку зрения Southern Surgeons Club, которая гласит, что недостаточный
опыт хирурга — главная причина повреждения желчных протоков. По данным
военных хирургов США, например, при исключении первых 10 лапароскопических
холецистэктомии, когда хирурги только набирают опыт, частота повреждения
желчных протоков снижается с 0,57 до 0,1 %. Даже если анализировать результаты
лапароскопических холецистэктомии, выполняемых с начала 1990-х гг., когда
опыт большинства хирургов был еще довольно ограниченным, все равно частота
повреждений желчных протоков при лапароскопических операциях вполне сравнима
с таковой во время традиционных открытых холецистэктомии.
18. Как классифицируются повреждения
желчных протоков?
В работах, отражающих повреждения
желчных протоков во время выполнения холецистэктомий, для того чтобы описать
тип и уровень повреждения желчных протоков, часто использовалась классификация
Висмута (Bismuth). Однако эта система изначально была разработана для послеоперационных
стриктур желчных протоков, развивающихся после открытых операций, и поэтому
не может быть применима в полной мере для повреждений желчных протоков
во время лапароскопических холецистэктомий. Уэрри (Wherry) и соавт. предложили
альтернативную классификацию повреждений желчных протоков, которая является
достаточно простой, позволяет делать прогноз и проводить сравнение между
различными группами пациентов. Согласно этой классификации, которая носит
название BDICS-системы, I тип повреждений желчных протоков представляет
собой повреждение боковой стенки общего желчного протока, когда хирург
осуществляет подготовку и выполняет интраоперационную холангиографию, ошибочно
приняв при этом общий желчный проток за пузырный. При быстром распознавании
такого повреждения боковой стенки общего желчного протока, пока хирург
не пересек его полностью (II тип повреждения по системе BDICS), можно просто
ушить дефект стенки общего желчного протока над Т-образным дренажом. В
отличие от этого, при III типе повреждения общего желчного протока (который
представляет собой полное пересечение и резекцию участка протока), даже
если его вовремя распознать, необходимо наложить холедохоеюноанастомоз,
что сопровождается значительно более длительными сроками выздоровления
пациентов, чем при I типе повреждений с простым ушиванием стенки холедоха.
Классификация повреждений желчных
протоков (BDICS)
|
1ТИП
|
II ТИП
|
III ТИП
|
|
|
Простое повреждение
стенки желчного протока
|
Полное пересечение
желчного протока
|
Пересечение
и резекция части желчного протока
|
|
По: Wherry D. С., Rob С. G., Marohn
M. R. et al. An external audit of laparoscopic cholecistectomy performed
in medical treatment facilities of the Department of Defense. Ann. Surg.,
220: 626-634,1994, с разрешения авторов.
19. Следует ли во время
лапароскопической холецистэктомии выполнять интраоперационную холангиографию
у всех пациентов или только у некоторых?
Основным принципом безопасного
выполнения операций на желчевыводящей системе является тщательная идентификация
желчных протоков перед тем, как Вы собираетесь перевязать или пересечь
любое анатомическое образование. Лучше всего помогает разобраться в анатомии
этой области выделение треугольника Кало. Однако хирурги, не имеющие еще
достаточного опыта выполнения лапароскопических операций, пытаются выделить
этот треугольник с точки зрения традиционного подхода (как это обычно делается
во время открытых операций). При этом чаще всего и происходит повреждение
желчных протоков. Для того чтобы четко разобраться в анатомии этой области
и обнаружить место слияния пузырного и общего печеночного протоков и место
формирования общего желчного протока, лучше всего выполнять интраоперационную
холангиографию. При препаровке тканей во время лапароскопической холецистэктомии
внимание хирурга должно концентрироваться на шейке желчного пузыря, с тем
чтобы и с медиальной и с латеральной стороны видеть место перехода шейки
пузыря в пузырный проток. Возражения против необходимости выполнения интраоперационной
холангиографии включают: прежде всего удлинение времени и повышение стоимости
операции, необходимость в специальном оборудовании и опыте хирурга для
выполнения этой манипуляции; частично и то, что хирурги, осваивая лапароскопическую
холецистэктомию, не уделяют интраоперационной холангиографии столько внимания,
сколько они уделяют тщательной препаровке тканей в области шейки пузыря;
а также тот факт, что этот вопрос никогда так жестко не ставится во время
традиционной холецистэктомии.
Преимущества выполнения интраоперационной
холангиографии во время лапароскопической холецистэктомии
Позволяет более точно идентифицировать
анатомию желчных протоков
Позволяет распознать отклонения от
нормальной анатомии желчных протоков (которые
наблюдаются приблизительно у 10 %
пациентов) Позволяет обнаружить камни в пузырном и общем желчном протоке
(выявляются у 7-12 %
пациентов, у которых до операции они
заподозрены не были) Позволяет обнаружить непреднамеренное повреждение
желчных протоков, а также уменьшить тяжесть этих повреждений (например,
предотвратить перевод I типа повреждения по системе
BDICS во II и III тип) Повышает опыт
и поддерживает квалификацию хирургов в выполнении интраоперационной холангиографии
В настоящее время существует
точка
зрения, согласно которой обычная интраоперационная холангиография необходима
для безопасного выполнения лапароскопической холецистэктомии. Интраоперационная
холангиография всегда обеспечивает хирурга важной информацией. Хирурги,
выступающие в защиту выполнения интраоперационной холангиографии при лапароскопической
холецистэктомии, считают, что холангиография позволяет предотвратить повреждение
желчных протоков при различных анатомических отклонениях, помогает обнаружить
камни в общем желчном протоке, повышает опыт хирургов и их уверенность
в себе в тех случаях, когда для выполнения интраоперационной холангиографии
существуют абсолютные показания, помогает хирургам приобрести необходимые
навыки для лапароскопичес-кого вскрытия общего желчного протока. Приблизительно
от 31 до 47 % всех хирургов во время лапароскопической холецистэктомии
всегда выполняют интраопера-ционную холангиографию.
При анализе повреждений
общего желчного протока во время лапароскопической холецистэктомии установлено,
что в этих случаях интраоперационная холангиография выполнялась крайне
редко. Эти данные свидетельствуют в пользу того, что выполнение интраоперационной
холангиографии позволяет уменьшить частоту и снизить тяжесть повреждений
желчных протоков. Исходя из опыта крупных центров лапароскопической хирургии
считается, что использование интраоперационной холангиографии не приводит
к снижению частоты небольших повреждений (повреждений I типа по классификации
BDICS) желчных протоков, поскольку проблемы с идентификацией стенки общего
желчного протока возникают еще до выполнения холангиографии. Однако интраоперационная
холангиография может уменьшить тяжесть повреждения, поскольку позволяет
идентифицировать протоки до полного их пересечения (повреждения II типа
по классификации BDICS) или до их пересечения и резекции (повреждения III
типа по классификации BDICS).
Хирурги, отстаивающие выполнение
интраоперационной холангиографии, считают, что на рентгенограммах не всегда
можно получить полную информацию о состоянии желчных протоков и поэтому
данные исследования нужно проводить под рентгеноскопическим экраном (рентгенохолангиоскопия).
Интраоперационная
холангиография позволяет выявить камни в желчных протоках приблизительно
у 7-12% пациентов, у которых до операции их наличие не подозревалось. Большая
часть таких камней, как правило, не вызывает каких-либо клинических последствий,
но в некоторых случаях просмотренные и оставленные в желчных протоках камни
приводят к возникновению восходящего холангита, острого панкреатита и закупорке
желчных протоков. С развитием механической желтухи, как правило, невозможно
предугадать, какие желчные камни пройдут в двенадцатиперстную кишку без
осложнений. Соответственно, многие хирурги предпринимают все возможные
попытки для того, чтобы во время холецистэктомии обнаружить все камни в
желчных протоках. При этом в протоках могут быть просмотрены только мелкие
камни (более 90 % всех оставленных в холедохе желчных камней диаметром
менее 6 мм самостоятельно проходят в двенадцатиперстную кишку).
Недостатки выполнения интраоперационной
холангиографии во время лапароскопической холецистэктомии
Требует затраты дополнительного времени
и повышает стоимость операции (в это входит собственно время операции,
стоимость дополнительного оборудования и рентгенологических исследований)
Результаты интраоперационной холангиографии
не всегда несут полезную информацию (в 2-5 % случаев не выявляются камни
в желчных протоках, в 10 % случаев не обнаруживаются различного рода анатомические
отклонения и в 1 % случаев не распознаются повреждения желчных протоков)
Большая часть камней общего желчного
протока не имеет большого клинического значения. Из тех, которые потенциально
несут какую-либо опасность, более 90 % могут быть удалены без операции
(с помощью ретроградной холангиопанкреатографии)
Во время интраоперационной холангиографии
иногда можно повредить желчные протоки (при введении катетера, при наложении
скобок и т. д.)
Интраоперационная холангиография не
приводит к снижению частоты повреждения желчных протоков
Ложноположительные результаты (которые
могут встречаться приблизительно в 20 % случаев) приводят к выполнению
напрасных и потенциально опасных холедохотомий или ЭРХПГ, что в свою очередь
приводит к увеличению времени лечения пациентов
Согласно существующей в
настоящее время противоположной точке зрения, селективное выполнение
интраоперационной холангиографии более предпочтительно. У пациентов, у
которых нет специальных показаний к проведению интраоперационной холангиографии,
обычная лапароскопическая холецистэктомия является более безопасной операцией
(риск повреждения желчных протоков или оставления в них камней невелик).
Необходимо осуществлять строгий отбор пациентов, которым показана интраоперационная
холангиография. Примерно 52 % хирургов во время лапароскопической холецистэктомии
выполняют интраоперационную холангиографию селективно (лишь по строгим
показаниям). Опытные хирурги утверждают, что тщательная и аккуратная
препаровка тканей является главным ключом для безопасного выполнения лапароскопической
холецистэктомии и что выполнение интраоперационной холангиографии никак
не увеличивает безопасность операции. Далее, сторонники селективной (по
строгим показаниям) интраоперационной холангиографии обращают внимание
на определенные ограничения методики и технологии интраоперационной холангиографии,
ее стоимость, невысокую производительность и потенциальный вред в тех случаях,
когда найденные изменения не требуют никаких дополнительных вмешательств.
Просмотренные камни или какие-либо изменения анатомии желчных протоков
отмечены менее чем в 1 % случаев, когда интраоперационная холангиография
выполнялась селективно. В других работах отмечено, что при выполнении селективной
интраоперационной холангиографии частота просмотренной важной для хирурга
информации составляет 3-5 %. Эффективность выявления клинически значимой
патологии с помощью интраоперационной холангиографии у пациентов, у которых
отсутствует анамнез панкреатита, концентрация печеночных ферментов в пределах
нормы, а размеры камней общего желчного протока не превышают 5 мм, составляет
менее 3 %. Поскольку эта группа включает до 50 % всех пациентов, которым
лапароскопическая холецистэктомия производилась в плановом порядке, показания
для выполнения у них интраоперационной холангиографии должны быть достаточно
строгими, если хирург во время операции четко идентифицировал анатомию
желчевыводящей системы. Резюме. В итоговом заключении, посвященном
желчнокаменной болезни и лапароскопической холецистэктомии, Национального
Института Здоровья подчеркнута важность четкой идентификации анатомии желчевыводящей
системы перед удалением желчного пузыря. Кроме того, в этом документе подчеркивается,
что во время лапароскопической холецистэктомии всегда должна быть возможность
выполнения высококачественной интраоперационной холангиографии и что канюлирование
пузырного протока — одна из важных составных частей подготовки всех хирургов,
выполняющих лапароскопическую холецистэктомию. Однако в этом документе
не сказано, что надо обязательно выполнять интраоперационную холангиографию.
20. Существуют ли какие-либо
альтернативы выполнению интраоперационной холангиографии?
1. Интраоперационная лапароскопическая
холедохоскопия. Лапароскопическая холедохоскопия, выполняемая через
пузырный проток, может в какой-то степени заменять холангиографию, однако
далеко не всегда. Введение тонкого холедохоскопа диаметром приблизительно
с холангиокатетер через отверстие в пузырном протоке в настоящее время
возможно. Холедохоскопия, как было показано, является более точным диагностическим
методом для обнаружения камней в желчных протоках. Потенциальными препятствиями
для выполнения холедохоскопии являются: необходимость приобретения дополнительного
оборудования; то, что манипуляцию должен проводить только опытный эндоскопист;
а также высокая стоимость исследования. Кроме того, при выполнении холедохоскопии
через пузырный проток даже во время открытой операции, как правило, возможно
тщательно осмотреть проксимальные отделы общего печеночного протока и внутрипеченочных
ветвей только в 50 % случаев. Однако при дальнейшем усовершенствовании
оборудования и методики эндоскопических исследований, а также с приобретением
достаточного опыта эндоскопистами интраоперационная холедохоскопия может
постепенно вытеснить холангиографию, поскольку, кроме обнаружения желчных
камней, она позволяет также удалять их из протоков.
2. Интраоперационное
лапароскопическое ультразвуковое сканирование. Эта методика, используемая
для обнаружения камней в желчных протоках и уточнения анатомии желчевыводящей
системы, обладает большей чувствительностью, чем интраоперационная холангиография.
При ее применении нет опасности повреждения желчных протоков, неправильной
трактовки анатомических нарушений, возникновения реакции на контрастное
вещество, а также нет необходимости в радиационном облучении пациентов.
По мере развития и усовершенствования лапароскопических ультразвуковых
зондов-датчиков ограничивать применение интраоперационного ультразвукового
сканирования будут не технологические проблемы, а только опыт хирурга.
При наличии достаточного опыта выполнения ультразвукового сканирования
во время лапароскопической холецистэктомии этот метод является наиболее
предпочтительным для четкого выяснения анатомии желчевыводящей системы
и предотвращения опасной препаровки тканей, которая может привести к повреждению
желчных протоков, особенно при остром холецистите.
21. Во что обходятся интраоперационная
холангиография, неудаление из желчных протоков камней и повреждение желчных
протоков?
Гонорар врача за выполнение
лапароскопической холецистэктомии — приблизительно $1400 за каждую операцию.
Общая стоимость лапароскопической холецистэктомии в среднем составляет
$5420. При проведении интраоперационной холангиографии стоимость операции
увеличивается на $500-700. При переходе на традиционную открытую холецистэктомию
и интраоперационную холангиографию общая стоимость операции увеличивается
приблизительно на $ 1260 и достигает $6680. При выполнении эндоскопической
ретроградной холангиопанкреатографии с удалением камней и/или сфинкте-ротомией
гонорар врача-эндоскописта составляет $1170, гонорар рентгенолога — $145,
стоимость оборудования — $1000. Общая стоимость процедуры при этом достигает
$2315. Приблизительный анализ стоимости различных вмешательств показывает,
что стоимость лапароскопической холецистэктомии с интраоперационной холангиографией
и, при необходимости, с переходом на открытую операцию меньше, чем стоимость
лапароскопической холецистэктомии и эндоскопической ретроградной холангиопанкреатографии
в послеоперационном периоде. Кроме того, эндоскопическую ретроградную хо-лангиопанкреатографию
в послеоперационном периоде в 10 % случаев выполнить не удается, она на
10 % увеличивает сроки лечения, а летальность при этом составляет 1 %.
Стоимость лечения повреждений желчных протоков II и III типов (по классификации
BDICS) составляет приблизительно $30 000 (эта цифра не включает гонорары
врачей). Филлипс (Phillips) утверждает, что избежание одного серьезного
осложнения на каждые 1000 лапароскопических холецистэктомии покрывает затраты
на выполнение всех "напрасных" холангиограмм.
22. Что делать в тех случаях,
когда в брюшную полость во время лапароскопической холецистэктомии попадают
желчь и желчные камни?
Существует точка зрения,
что выпавшие в брюшную полость желчные камни не имеют большого значения
и хирург может их оставить. Выпадение в брюшную полость желчных камней
во время лапароскопической холецистэктомии происходит приблизительно в
30-50 % случаев, однако частота развития внутрибрюшных абсцессов составляет
только 0,1-0,3 %. По данным Сопера (Soper), из 250 пациентов, которым была
выполнена лапароскопическая холецистэктомия, перфорация желчного пузыря
и попадание желчи в брюшную полость наблюдались у 32 %. Не существует никаких
различий в результатах операций, особенно по частоте развития послеоперационных
гнойных осложнений, между группами пациентов, у которых желчь во время
операции попала в брюшную полость и у которых желчь в брюшную полость не
попала. Статистический анализ частоты попадания в брюшную полость во время
операции желчи и желчных камней и частоты развития в дальнейшем внутри-брюшных
абсцессов позволил большинству хирургов сделать заключение, что причин
для серьезного беспокойства при попадании в брюшную полость во время лапароскопической
холецистэктомии желчи и желчных камней нет. Существует противоположная
точка зрения, которая заключается в том, что попавшие в брюшную полость
во время операции желчные камни являются потенциальным источником образования
в послеоперационном периоде внутрибрюшных абсцессов и свищей и поэтому
их следует обязательно удалять. Несмотря на несовпадение частоты выпавших
в брюшную полость желчных камней и числа возникающих в результате этого
осложнений, величина, тип и время развития (после операции) этих осложнений
вызывают определенный интерес. В экспериментальных исследованиях на животных
установлено, что при попадании в брюшную полость желчных камней в сочетании
со стерильной или инфицированной желчью повышается частота образования
внутрибрюшных абсцессов и спаек. На основании этих исследований сделан
вывод о необходимости удаления из брюшной полости выпавших из желчного
пузыря во время выполнения лапароскопической холецистэктомии желчных камней.
Крупные внутрибрюшные абсцессы и свищи, возникающие после операций, должны
настораживать хирургов и заставлять их предпринимать попытки удаления попавших
в брюшную полость больших и множественных желчных камней. Для облегчения
удаления из брюшной полости желчных камней существуют специальные стерильные
пакеты и специальные лапароскопические ложки.
23. Есть ли необходимость
в использовании с профилактической целью после лапароскопической холецистэктомии
антибиотиков?
Поскольку частота попадания
желчи в брюшную полость во время лапароскопической холецистэктомии, по
данным большинства авторов, составляет 30-50 %, и результаты основных бактериологических
исследований свидетельствуют о том, что в норме желчь бывает инфицирована
в 30-40 % случаев, и поскольку при остром холецистите желчь инфицирована
в 60 % случаев, то большинство хирургов предпочитают всегда после лапароскопической
холецистэктомии с профилактической целью назначать антибиотики. После обычной
лапароскопической холецистэктомии адекватную профилактику обеспечивают
антибиотики цефалоспоринового ряда первого поколения, которые воздействуют
на большинство обычных микроорганизмов. Некоторые хирурги предпочитают
использовать для этой цели цефалоспорины второго поколения. Для того чтобы
получить окончательный ответ на вопрос, необходимо ли после лапароскопической
холецистэктомии с профилактической целью всегда назначать антибиотики,
следует провести проспективное рандомизированное исследование.
24. В течение 24 ч после
традиционной открытой холецистэктомии с использованием косого подреберного
доступа у пациентов наблюдается снижение форсированной жизненной емкости
легких (ФЖЕЛ), форсированного объема выдоха в течение 1-й секунды (FEV-1)
и форсированного потока выдоха от 25 % до 75 % (FEE 25-75 %) почти на 50
% от нормальных цифр. На сколько снижаются эти функциональные легочные
тесты через 24 ч после лапароскопической холецистэктомии?
Послеоперационные функциональные
легочные тесты после лапароскопических и открытых операций

При измерении функциональных
легочных тестов через 24 ч после выполнения лапароскопической холецистэктомии
обнаружено, что снижение функции легких при этом приблизительно в 2 раза
меньше того, которое наблюдается после традиционной открытой холецистэктомии.
Для проведения проспективного рандомизированного исследования с целью сравнения
влияния на функции легких открытых и лапароскопических операций были подобраны
группы пациентов, соответствующих друг другу по возрасту, полу и массе
тела. При этом функциональные легочные тесты измерялись до и после операции.
ФЖЕЛ и FEV-1 уменьшались приблизительно одинаково, но меньше после лапароскопической,
чем после открытой холецистэктомии. FRC (функциональная остаточная емкость
легких) была значительно выше через 72 ч после лапароскопической, чем после
открытой операции. После лапароскопической холецистэктомии дыхательная
система угнеталась в меньшей степени, а восстановление ее функций происходило
быстрее.
25. 18-летняя женщина
с гемоглобинопатией госпитализирована в клинику для выполнения плановой
лапароскопической холецистэктомии. Операция была проведена без осложнений,
однако в послеоперационном периоде наклейка, наложенная на рану в области
пупка, постоянно промокала. При биохимическом исследовании этой жидкости
установлено, что концентрация креатинина в ней составляет 200 мг/л. Во
время операции пациентке в мочевой пузырь был заведен катетер Фолея (Foley),
по которому поступала нормальная моча, поэтому хирург был уверен, что он
не повредил мочевой пузырь. Какой у пациентки может быть диагноз? Какие
анамнестические данные могли бы помочь предотвратить развитие этого осложнения?
У пациентки имеется врожденная
анатомическая аномалия, которая носит название "пузырно-пупочный свищ",
или незаращенный синус (или дивертикул) урахуса (мочевого протока), который
был поврежден во время введения в брюшную полость троакара. При наличии
в анамнезе сведений о хроническом или эпизодическом поступлении из пупка
жидкости хирург провел бы обследование для обнаружения возможного остатка
мочевого протока, что позволило бы устранить эту патологию одновременно
с выполнением лапароскопической холецистэктомии. Это было бы значительно
проще, чем лечить возникшее осложнение после операции. В целом подтекание
из мест введения троакаров жидкости в течение 8-12 ч после операции встречается
не так уж редко, однако постоянное подтекание жидкости в течение 24 ч должно
насторожить хирурга и натолкнуть на мысль о необходимости обследования
для исключения возможного скрытого повреждения внутренних органов.
26. Каким главным принципом
должен руководствоваться хирург для принятия решений во время выполнения
малоинвазивных операций?
Хирург должен стремиться
выполнять видеоэндоскопические операции в соответствии с принципами, установленными
для стандартных открытых операций. Малоинвазивная хирургия представляет
собой не новый раздел хирургии, а новый способ доступа к внутренним
органам для постановки диагноза заболевания, определения стадии опухоли
и выполнения собственно оперативного вмешательства, включая его восстановительный
этап. Принципы хирургии при этом ни в коем случае не меняются. Нелегкой
задачей современного хирурга является не только необходимость приобретении
навыков для проведения видеоэндоскопических операций, но также и применение
ух в соответствии с установленными в хирургии принципами максимальной безопасности
пациента и получения наилучшего результата операции.