ГЛАВА 71. АЛЛЕРГИЧЕСКИЕ ПРОЯВЛЕНИЯ
ЗАБОЛЕВАНИЙ ЖЕЛУДОЧНО-КИШЕЧНОГО ТРАКТА
1. Каким образом можно различить реакцию
непереносимости пищи от настоящей анафилактической реакции, связанной с
приемом пищи? Назовите возможные механизмы развития реакции непереносимости
пищи.
Реакции непереносимости пищи
охватывают широкий спектр клинических проявлений, которые развиваются после
приема пищевых продуктов или пищевых добавок. Эту обширную группу можно
подразделить на две основные подгруппы: опосредованные иммунологически
и не опосредованные иммунологически реакции непереносимости пищи.
Реакции непереносимости пищи
|
ОПОСРЕДОВАННЫЕ
ИММУНОЛОГИЧЕСКИ (ПИЩЕВАЯ АЛЛЕРГИЯ)
|
НЕ ОПОСРЕДОВАННЫЕ
ИММУНОЛОГИЧЕСКИ (НЕПЕРЕНОСИМОСТЬ ПИЩИ)
|
|
|
Пищевая анафилаксия
|
Пищевые токсические
реакции
|
|
|
Отсроченные
(замедленные) реакции
|
Фармакологические
пищевые реакции
|
|
|
Глютенчувствительная
энтеропатия
|
Метаболические
пищевые реакции
|
|
|
Аллергия
на коровье молоко (кишечная)
|
|
|
Синонимом для термина
пищевая аллергия является термин иммунологически опосредованные
реакции непереносимости пищи, из которых наиболее широко распространена
пищевая анафилаксия. Клинические проявления анафилаксии включают
симптомы крапивницы, ангионевротического отека, бронхиальной астмы, отека
гортани, тошноты и рвоты, гипотензии, а также возможно развитие коллапса
с летальным исходом. Симптомы заболевания развиваются немедленно или в
пределах 1-2 ч после приема пищевого аллергена. Прочие иммунологически
опосредованные реакции непереносимости пищи включают аллергию на коровье
молоко у детей, клинические проявления которой развиваются с определенной
задержкой.
Не опосредованные иммунологически
реакции непереносимости пищи часто называют просто непереносимостью
пищи, которая включает пищевые отравления, фармакологические реакции
и метаболические реакции. Пищевые отравления вызываются непосредственным
действием пищи или пищевых примесей, в результате которого возникают выраженные
клинические симптомы, например отравление ядом скумбриевых рыб возникает
при употреблении в пищу рыбы, содержащей гистамин, который накапливается
в несвежей (портящейся) рыбе. Клинические проявления пищевых отравлений
включают гиперемию лица, тошноту, рвоту, диарею, головную боль и, возможно,
гипотензию. Фармакологические пищевые реакции возникают в результате
прямого фармакологического воздействия пищи или пищевых добавок, которое
вызывает развитие четко определенных клинических симптомов. Например, у
пациентов с мигренозными головными болями приступы мигрени могут провоцироваться
употреблением в пищу шоколада или сыра, так как в каждом из этих продуктов
содержится фенилэтиламин, принадлежащий к группе вазоактивных моноаминов.
Примером метаболических пищевых реакций является недостаточность
лактозы, в результате которой возникают кишечные реакции при употреблении
в пищу молока.
2. Диагноз пищевой анафилаксии ставится
в том случае, когда клинические проявления развиваются в течение короткого
промежутка времени после приема какого-либо пищевого аллергена. Какие дополнительные
исследования можно провести для подтверждения диагноза пищевой анафилаксии?
Немедленное развитие клинических проявлений
анафилактической
реакции после употребления пищевого аллергена значительно упрощает
постановку диагноза пищевой анафилаксии, однако пациент часто употребляет
несколько пищевых продуктов одновременно или клинические проявления могут
развиваться спустя 1 — 2 ч после приема пищи. Чтобы установить, какой именно
продукт является пищевым аллергеном, проводятся скарификационные кожные
пробы с пищевыми продуктами, которые и завершают постановку диагноза.
Пищевые продукты для проведения скарификационных тестов выбирают на основании
анамнестических данных. Скарификационные кожные пробы проводятся с возможными
аллергенами в концентрации 1 : 20 и считаются положительными только в том
случае, если согласуются с данными анамнеза. Ложноположительные результаты
скарификационных кожных проб с пищевыми продуктами встречаются очень часто,
и выявление положительных результатов вовсе не означает, что у пациента
обязательно имеется пищевая аллергия. При тщательном выполнении скарификационных
кожных проб их отрицательные результаты позволяют с высокой точностью определить
отсутствие специфических IgE и невозможность развития анафилактических
реакций в будущем.
Метод радиоаллергоабсорбции (РАА) представляет
собой выявление циркулирующих IgE in vitro. Этот метод редко бывает
необходим для установления диагноза пищевой аллергии, но показан пациентам
с редкими формами пищевой аллергии. Известны редкие формы пищевой аллергии,
особенно к арахису, когда даже открывание банки с арахисовым маслом приводит
к появлению симптомов аллергии. У таких пациентов высок риск развития тяжелой
анафилактической реакции при проведении скарификационных кожных проб и
поэтому целесообразно проведение безопасных ра-диоаллергоабсорбционных
тестов от vitro.
У некоторых пациентов при проведении кожных
скарификационных тестов выявляется положительная реакция на многие пищевые
продукты, и в таком случае невозможно установить, какой из них вызывает
развитие анафилактической реакции, или правильность диагноза анафилаксии
вообще вызывает сомнения. В подобных случаях для уточнения диагноза пациенту
осторожно последовательно вводят возможные аллергены per os как
в виде обычной пищи, так и двойным слепым, плацебоконтролируемым методом.
Этот тест должен проводить специалист, хорошо знакомый с этим провокационным
методом и обладающий опытом в лечении анафилаксии.
3. Хорошо известно, что некоторые пищевые
продукты вызывают пищевую анафилаксию. Перечислите их.
|
У ВЗРОСЛЫХ
|
У ДЕТЕЙ
|
|
|
Арахис
|
Молоко
|
|
|
Грецкие орехи
|
Яйца
|
|
|
Ракообразные
|
Арахис
|
|
|
Рыба
|
Соя
|
|
|
|
Пшеница
|
|
|
|
Рыба
|
|
К пищевым продуктам, наиболее
часто вызывающим анафилаксию у взрослых, относятся арахис, грецкие орехи,
ракообразные (креветки, крабы и раки) и рыба. К пищевым продуктам, вызывающим
анафилаксию у детей, относятся арахис, молоко, яйца, соя, пшеница и рыба.
Установлено, что гиперчувствительность к арахису не исчезает с течением
времени, поэтому она широко распространена как среди детей, так и среди
взрослых. Помимо этих широко распространенных аллергенов анафилактическую
реакцию могут вызывать любые потребляемые пищевые продукты, даже такие,
казалось бы, неподходящие, как семена хлопка и кунжута. Большинство пациентов
чувствительны к одному или двум видам пищи, множественная пищевая аллергия
встречается редко.
4. Какие основные меры, кроме исключения
из рациона пищевого аллергена, показаны при лечении пациентов с пищевой
анафилаксией?
Если установлено, какой именно вид пищи
вызывает развитие анафилаксии у пациента, необходимо полностью исключить
этот продукт из пищевого рациона. Кроме того, необходимо:
1. Применение эпинефрина (адреналина)
в виде инъекций для самостоятельного введения при случайном приеме
пищевого аллергена. Это происходит наиболее часто в ресторанах и при приеме
пищи вне дома. При появлении начальных признаков анафилаксии пациент должен
самостоятельно ввести себе эпинефрин, также целесообразно при этом применять
антигистаминные препараты peros. Пациенты, страдающие пищевой аллергией,
должны придерживаться этих правил, когда принимают пищу вне дома. Такие
пациенты должны получить инструкции о правилах применения эпинефрина и
вызова "скорой помощи" при развитии неконтролируемой анафилактической реакции.
2. На этикетках пищевых продуктов должен
быть указан полный состав ингредиентов, особенно это актуально для
сладостей. Некоторые наборы конфет и леденцов содержат арахис и орехи,
однако сведений об этом на этикетке мы не найдем.
5. Верно ли утверждение, что у пациентов
с аллергией к арахису употребление в пищу древесных орехов также приводит
к развитию аллергической реакции?
Между древесными орехами и арахисом, относящимся
к бобовым культурам, отсутствует перекрестное реагирование. Пациенты с
аллергией к арахису без опасения могут есть древесные орехи, например пекан
и грецкие орехи. Также пациенты с аллергией к арахису и сое могут употреблять
в пищу арахисовое и соевое масло без развития каких-либо осложнений. При
проведении исследований in vitro выявлено перекрестное реагирование
между различными ракообразными, поэтому, например, пациентам с аллергией
к креветкам следует избегать употребления в пищу раков и крабов вплоть
до проведения полного обследования.
6. Существует ли связь между реакцией
пациентов на рентгеноконтрастные препараты и анафилактической реакцией
на морепродукты?
Системные реакции на введение рентгеноконтрастных
препаратов часто обозначаются как "йодная аллергия", и пациентам, у которых
возможно развитие таких реакций, рекомендуют избегать употребления морепродуктов.
Аллергия
к морепродук-там представляет собой опосредованную IgE реакцию, приводящую
к развитию симптомов анафилаксии, которая возникает при употреблении в
пищу ракообразных или моллюсков (устриц и двустворчатых морских моллюсков).
Наиболее распространена и хорошо описана анафилактическая реакция на креветки.
Несколько проведенных in vitro
исследований показали, что аллергеном,
вызывающим развитие анафилаксии при употреблении в пищу креветок, является
определенный белок; сывороточные IgE к этому "креветочному" белку вызывают
развитие анафилактической реакции. Таким образом, этот аллерген не является
производным йода. Реакции на рентгеноконтрастные препараты
возникают
после введения йодсодер-жащих высокоосмолярных рентгеноконтрастных препаратов
и приводят к развитию системных симптомов, которые похожи на симптомы анафилактической
реакции. Такая реакция связана с высокой осмолярностью рентгеноконтрастных
препаратов, непосредственное воздействие которых вызывает выделение гистамина
и активацию комплемента с развитием системных проявлений. В основе клинических
проявлений лежит не реакция IgE на йодиды или йодсодержащие рентгеноконтрастные
препараты, и она не является истинной "йодной аллергией". Термин "йодная
аллергия" полезен только для выделения пациентов, у которых развивается
реакция на рентгеноконтрастные препараты. Таким образом, не существует
взаимосвязи между реакциями на рентгеноконтрастные препараты и анафилаксией,
возникающей при употреблении в пищу креветок или других морепродуктов.
7. Пациенты, страдающие от сезонного
аллергического ринита, часто предъявляют жалобы на появление зуда в полости
рта и глотке после употребления свежих фруктов. В чем сущность этого заболевания
и в чем заключается его связь с аллергическим ринитом?
Пациенты, у которых приступы аллергического
ринита вызываются амброзией, в течение длительного времени предъявляют
жалобы на появление зуда в полости рта и глотке после употребления арбуза.
В настоящее время данные проявления описаны как синдром оральной аллергии,
который
включает зуд губ, языка, нёба и ротоглотки и, иногда, ангионевротический
отек в этих же областях. Эта реакция редко сопровождается системными проявлениями
и обычно быстро проходит без каких-либо последствий. У пациентов с сенной
лихорадкой, возникающей при контакте с амброзией, симптомы заболевания
могут возникать после употребления в пищу яблок, сельдерея и моркови. Другие
свежие фрукты и овощи, включая персики, груши и картофель, также могут
вызывать развитие этих симптомов. Синдром оральной аллергии встречается
у пациентов с аллергическим ринитом и, как правило, проходит самостоятельно.
8. Верно ли утверждение, что пищевая
аллергия играет роль в развитии синдрома раздраженной кишки?
Синдром раздраженной кишки до настоящего
времени остается достаточно частым заболеванием желудочно-кишечного тракта,
причем этиология его по-прежнему до конца не ясна, за исключением некоторых
явных нарушений двигательной активности кишки. Было проведено несколько
исследований, с тем чтобы установить, имеет ли отношение пищевая аллергия
к развитию синдрома раздраженной кишки, но выявить какую-либо связь при
этом не удалось. Определенные виды пищи, например молочные продукты, могут
вызывать развитие симптомов заболевания у таких пациентов при наличии сопутствующей
недостаточности лактазы, но истинная пищевая гиперчувствительность не является
причиной и не провоцирует развитие синдрома раздраженной кишки.
9. Какие хронические заболевания желудочно-кишечного
тракта могут осложнять течение бронхиальной астмы?
Желудочно-пищеводный рефлюкс часто встречается
у пациентов, страдающих бронхиальной астмой, и может осложнять течение
астмы и ее лечение. Кроме того, теофиллин, применяемый для лечения бронхиальной
астмы, снижает давление нижнего пищеводного сфинктера и, таким образом,
усиливает уже существующий у астматиков желудочно-пищеводный рефлюкс. Основным
механизмом при этом является вагусный рефлекс бронхоспазма при попадании
кислоты в проксимальный отдел пищевода и микроаспирация кислого желудочного
содержимого, вызывающая бронхо-спазм в результате прямого раздражения бронхов.
У пациентов с бронхиальной астмой и симптомами желудочно-пищеводного рефлюкса
появление ночных и более тяжелых приступов, скорее всего, связано с тем,
что рефлюкс кислоты осложняет течение бронхиальной астмы.
При обследовании пациентов с желудочно-пищеводным
рефлюксом наиболее информативным исследованием является так называемое
астма-рефлюкс
исследование. Это исследование заключается в повторном проведении пикфлоуметрии
или спиро-графии с частыми интервалами и одновременным измерением рН в
просвете пищевода для установления связи снижения скорости тока воздуха
и уровнем рН в просвете пищевода. У таких пациентов применение блокаторов
Н2-рецепторов гистами-на или омепразола значительно снижает
выраженность симптомов желудочно-пищеводного рефлюкса и уменьшает потребность
в медикаментозной терапии бронхиальной астмы. С другой стороны, обнаружение
рефлюкса у пациентов с бронхиальной астмой при мониторировании рН пищевода
или рентгенологическом исследовании не является само по себе свидетельством
их причинно-следственных отношений. В таком случае для установления значимости
влияния желудочно-пищеводного рефлюкса на течение бронхиальной астмы проводится
антирефлюксная терапия. Конечным этапом данного обследования является использование
объективных критериев для установления причинной зависимости между желудочно-пищеводным
рефлюксом и бронхиальной астмой, таких как улучшение показателей спирометрии,
уменьшение ночных приступов астмы или уменьшение потребности в применении
p-адреноли-тиков.
10. Наличие каких паразитарных
инфекций можно заподозрить у пациентов с эози-нофилией?
Связь эозинофилии с паразитарными
инфекциями установлена давно, но наиболее наглядным примером этой связи
являются гельминтные, а не протозойные инфекции. Проникновение паразитов
в ткани организма предшествует и является причиной развития эозинофилии,
а паразиты, обитающие строго в просвете кишки, такие как Enterobius
(острицы)
и Trichuris (власоглав), обычно не приводят к эозинофилии в периферической
крови. Стронгилоидоз, шистосомоз, аскаридоз и филяриоз — примеры паразитарных
инфекций, поражающих различные ткани организма и приводящих к развитию
эозинофилии в периферической крови. Так как поражение тканей является определяющим
критерием, исследование каловых масс с целью обнаружения в них гельминтов
и их яиц может быть недостаточным при обследовании пациентов с эозинофилией
периферической крови. При подозрении на наличие паразитарной инфекции для
установления диагноза проводятся непосредственные исследования других жидких
сред организма и даже множественные биопсии тканей.
11. Эозинофильный гастроэнтерит
сопровождается эозинофилией периферической крови. Какие клинические симптомы
позволяют предположить наличие данного заболевания?
Это редкое заболевание характеризуется
эозинофилией периферической крови, эозинофильными инфильтратами желудочно-кишечного
тракта и различными симптомами поражения желудочно-кишечного тракта, которые
определяются локализацией и глубиной поражения слизистой оболочки кишки.
К наиболее частым симптомам эозинофильного гастроэнтерита относятся послеобеденная
тошнота и рвота, схваткообразные боли в животе, диарея и снижение массы
тела. Эти симптомы — типичные проявления поражения слизистой оболочки желудочно-кишечного
тракта. Другими значимыми симптомами заболевания являются наличие скрытой
крови в каловых массах, железодефицитная анемия, белоктеряющая энтеропатия
и задержка роста. В случае инфильтрации мышечной оболочки желудочно-кишечного
тракта возможно возникновение симптомов нарушения эвакуации из желудка
или тонкой кишечной непроходимости. Вовлечение серозной оболочки кишки
в патологический процесс приводит к развитию асцита; при этом в асцитической
жидкости присутствуют эозинофилы.
При наличии этих клинических
симптомов и эозинофилии периферической крови для постановки точного диагноза
целесообразно проведение биопсии слизистой оболочки желудка и тонкой кишки.
При этом в патологический процесс часто вовлекается антральный отдел желудка,
и в связи с этим забор образцов ткани для гистологического исследования
нужно начинать именно в этом месте. Следует также проводить множественную
биопсию слизистой оболочки тонкой кишки, так как поражение кишки может
носить так называемый "пятнистый", или островковый, характер. Обнаружение
в забранных участках ткани эозинофильных инфильтратов позволяет поставить
правильный диагноз.
12. Какие скрининговые
методы применяются при обследовании пациентов с рецидивирующим ангионевротическим
отеком и рецидивирующими приступами тонкокишечной непроходимости?
У пациентов с рецидивирующим
ангионевротическим отеком, не сопровождающимся кожным зудом и крапивницей,
исследуется концентрация С4 фракции комплемента для установления диагноза
врожденного
ангионевротического отека. Пациенты с более распространенным вариантом
сочетания крапивницы и ангионевротического отека не нуждаются в проведении
этого скринингового исследования, так как характерным признаком врожденного
ангионевротического отека является его изолированность. Пониженная концентрация
С4 фракции комплемента свидетельствует о вторичной по отношению к недостаточности
ингибитора С1 эстеразы активации системы комплемента. При выявлении у пациента
низкой концентрации С4 фракции комплемента проводится исследование концентрации
сывороточного ингибитора С1 и его функциональной активности; обнаружение
при этом пониженной концентрации С1 или его дисфункции является свидетельством
наличия у пациента врожденного ангионевротического отека.
У пациентов с врожденным
ангионевротическим отеком обычно имеются родственники, страдающие ангионевротическим
отеком, а в анамнезе присутствуют указания на рецидивирующий ангионевротический
отек, в типичных случаях локализующийся на губах, в периорбитальной области,
на конечностях или в области половых органов. Ангионевротический отек может
поражать желудочно-кишечный тракт, приводя к возникновению рвоты, диареи,
коликообразных болей в животе и тонкокишечной непроходимости. Наличие в
анамнезе у пациентов ангионевротического отека при отсутствии лихорадки
и лейкоцитоза во время острых симптомов поражения желудочно-кишечного тракта
свидетельствует в пользу этого диагноза. У некоторых пациентов возможно
первичное развитие рецидивирующей тонкокишечной непроходимости как forme
fruste (приостановление в развитии или скрытое течение) заболевания,
и только исследование концентрации С4 фракции комплемента позволяет правильно
поставить диагноз. Наиболее опасным симптомом при развитии ангио-невротического
отека является отек гортани, который может привести к смертельному исходу;
в этом случае крайне важно осуществить быстрое восстановление проходимости
дыхательных путей.
13. Опишите органы иммунной
системы, расположенные в слизистой оболочке желудочно-кишечного тракта.
Какие иммуноглобулины преимущественно вырабатываются в этой системе?
Иммунная система слизистой
оболочки желудочно-кишечного тракта представлена организованной лимфоидной
тканью, которая относится к кишечно-ассоциирован-ной (или кишечной)
лимфоидной ткани (см. приведенный ниже рисунок). Эта лим-фоидная ткань
регулирует проникновение антигенов через слизистую оболочку кишки с помощью
специализированных клеток, которые носят название мембранозных клеток (М-клеток).
М-клетки обеспечивают транспорт везикул с макромолекулами из просвета кишки
в субэпителиальные ткани. Эти клетки располагаются над лим-фоидными фолликулами,
которые носят название пейеровых бляшек и в которых находятся центры
образования В-лимфоцитов. Особенностью этих В-лимфоцитов является преобладание
так называемых несущих IgA В-клеток, для которых предопределена функция
образования IgA.
Кроме очаговых скоплений
лимфоидной ткани имеется также диффузная сеть лимфоидной ткани, пронизывающая
слизистую оболочку всего желудочно-кишечного тракта. Эта лимфоидная ткань
дает начало двум своеобразным популяциям лимфоцитов: (1) внутриэпителиальным
лимфоцитам, располагающимся в пределах слоя эпителиальных клеток и в большинстве
своем представленными Т-клетками, и (2) лимфоцитам собственной пластинки
слизистой оболочки, представленным смешанной популяцией Т- и В-клеток.
Среди В-клеток лимфоцитарной популяции собственной пластинки слизистой
оболочки также преобладают IgA-продуцирующие В-клетки.
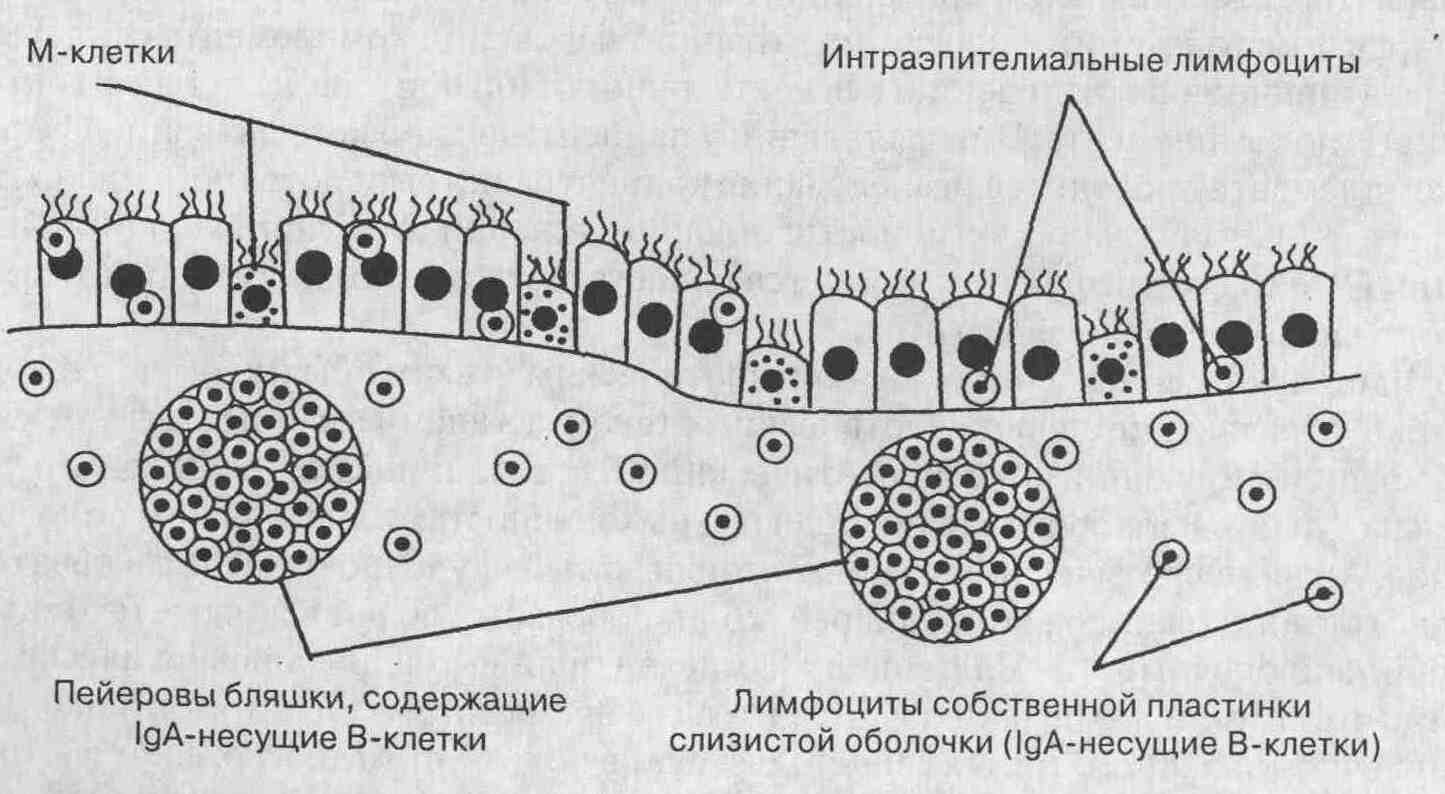
Компоненты кишечной лимфоидной ткани
и популяции лимфоцитов
14. Наблюдается ли у пациентов
с сочетанием лямблиоза и рецидивирующих синусно-легочных инфекций нарушение
гуморального иммунитета?
Рецидивирующие синусно-легочные
инфекции позволяют предположить наличие у пациентов иммунодефицита, обусловленного
гипогаммаглобулинемией, которую можно диагностировать при исследовании
концентрации иммуноглобулинов в сыворотке крови. Приобретенная гипогаммаглобулинемия,
или
вариабельный
неклассифицируемый иммунодефицит,— гетерогенное нарушение дифференциации
В-клеток, от которого страдает секреция иммуноглобулинов. Кроме рецидивирующих
пневмоний и синуситов, у таких пациентов развивается лямблиоз вследствие
иммунодефицита. Лямблиоз обычно проявляется диареей и может сопровождаться
синдромом мальабсорбции. Лечение лямблиоза проводится в соответствии со
стандартными медикаментозными схемами; проведение ежемесячных заместительных
инфузий гам-маглобулина позволяет уменьшить частоту возникновения лямблиоза
и других инфекций. Напротив, у пациентов с селективным дефицитом
IgA
лямблиоз развивается редко, и только у очень незначительной части пациентов
возникают рецидивирующие синусно-легочные инфекции.
15. Какие проявления со
стороны желудочно-кишечного тракта позволяют с высокой точностью предположить
наличие у пациента хронического гранулематоз-ного заболевания?
Выявление у мальчиков гепатомегалии,
возникающей при развитии абсцесса печени, язвенного стоматита, диареи,
абсцессов промежности, сопровождающихся лимфадено-патией, остеомиелита
и пневмонии позволяет предположить наличие у них хронического гранулематозного
заболевания. Помимо перечисленных проявлений, обнаружение в тканях таких
возбудителей, как Staphylococcus aureus и S. epidermidis, Serratia
marcescens, Pseudomonas, Candida и Aspergillus, также позволяет
предположить наличие у пациентов хронического гранулематозного заболевания.
Это достаточно редкое заболевание, наследуемое главным образом по сцепленному
с Х-хромосомой рецессивному типу, хотя описаны также случаи аутосомного
наследования. Дефект фагоцитов респираторного тракта возникает вторично
при недостаточности НАД Ф-оксидазы и приводит к неэффективности внутриклеточного
разрушения бактериальных и грибковых микроорганизмов в нейтрофилах. Недостаточность
НАДФ-оксидазы развивается вследствие отсутствия или дисфункции цитохрома
b, но в настоящее время описаны и другие нарушения этого крайне важного
для организма фермента.
16. Какие иммунодефицитные
нарушения могут развиваться при белоктеряющей энтеропатии? Какие лабораторные
исследования необходимо провести для постановки правильного диагноза?
Воспалительные заболевания
кишки могут приводить к потере иммуноглобулинов и других белков с калом,
т. е. белоктеряющей энтеропатии. Поставить правильный диагноз позволяет
снижение концентрации иммуноглобулинов в сыворотке крови, однако, так как
потери белка носят неспецифический характер, наряду с гипогаммаглобулинемией
у таких пациентов может встречаться и гипоальбуминемия. Белоктеряющая энтеропатия
может развиваться при ряде заболеваний желудочно-кишечного тракта, включая
тяжелую болезнь Крона, неспецифический язвенный колит, глютенчувствительную
энтеропатию и белоктеряющую гастропатию при болезни Менетрие. Кроме потери
белков, при энтеропатии возможна также потеря лимфоцитов, особенно при
заболеваниях, поражающих лимфоциты кишки, включая кишечные лимфан-гиэктазии.
При подсчете лимфоцитов выявляется лимфопения, и тест с гиперчувствительностью
замедленного типа отражает анергию, связанную со значительными потерями
лимфоцитов. К счастью, оба эти нарушения иммунной системы не имеют тесной
корреляции с увеличением инфекционной заболеваемости.
17. Опишите желудочно-кишечные проявления
острой реакции "трансплантат против хозяина".
Острая реакция "трансплантат против хозяина"
развивается при повреждении имму-нокомпетентными лимфоцитами донора тканей
хозяина, в основном после трансплантации костного мозга. При острой реакции
"трансплантат против хозяина" преимущественно поражаются кожа, желудочно-кишечный
тракт и печень. Отличительными признаками желудочно-кишечных проявлений
при реакции отторжения трансплантата являются интенсивная диарея и схваткообразные
боли в животе через несколько недель после проведения трансплантации. Диарея
может достигать больших объемов, в результате чего организм теряет белки
и электролиты. Клинические проявления поражения печени при этом варьируют
от субклинической гипербилирубинемии до желтухи и гепатомегалии. Появление
макулопапулезных кожных высыпаний одновременно с диареей и гипербилирубинемией
характерно для реакции "трансплантат против хозяина" в отличие от симптомов
поражения желудочно-кишечного тракта, вызванных инфекционными и другими
причинами. При хронической реакции отторжения интересно то, что у пациентов
развиваются поражения пищевода, включая дисфагию, одинофагию и стриктуры
пищевода. Хроническая реакция отторжения обычно наблюдается спустя месяцы
и также сопровождается хроническими поражениями кожи и заболеваниями печени.
18. Две значительные эпидемии, сопровождающиеся
периферической эозинофилией, развились после употребления в пищу двух различных
пищевых продуктов. В чем сущность этих заболеваний и что это за продукты?
Две упомянутые эпидемии представлены так
называемым синдромом токсического масла и синдромом миалгии с эозинофилией.
Синдром
токсического масла встречался в Испании в 1981 г. и проявлялся кашлем,
нарушением дыхания, лихорадкой, легочными инфильтратами, эозинофилией периферической
крови, рвотой, диареей и сыпью, иногда у пациентов развивались нейромышечные
паралитические симптомы. Возникновение этого синдрома было связано с употреблением
нелегально производимого и продаваемого растительного масла с высоким содержанием
рапсового семени. Во время эпидемии заболело приблизительно 20 000 человек.
Синдром
миалгии с эозинофилией возник примерно в 1989 г. в США и включает острое
развитие миалгии, эозинофилии в периферической крови, кожных высыпаний
и лихорадки. У некоторых пациентов заболевание переходило в хроническую
нейромышечную фазу. В основе развития этого синдрома лежит потребление
больших количеств L-триптофана, который содержится в пищевых примесях.
В диетических магазинах L-триптофан свободно продается и
применяется при бессоннице и некоторых других заболеваниях.