ГЛАВА 28.АСЦИТ
1. Каковы наиболее распространенные
причины асцита?
Асцит — это скопление жидкости
в брюшной полости. Более чем 80 % пациентов с асцитом страдают декомпенсированным
хроническим заболеванием печени. Тем не менее необходимо знать и другие
возможные причины асцита, т. к. лечение и прогноз при этих состояниях могут
в значительной степени отличаться. Вторая по частоте причина асцита — карциноматоз
брюшины. Далее следуют острый алкогольный гепатит, сердечная недостаточность,
молниеносная или подострая печеночная недостаточность, заболевания поджелудочной
железы, так называемый "диализный" асцит (возникающий у больных, находящихся
на диализе), нефротический синдром, обструкция печеночных вен, хилезный
асцит, желчный асцит и различные заболевания брюшины.
2. Всем ли пациентам с
асцитом, поступающим в стационар, необходимо выполнять диагностическую
эвакуацию асцитической жидкости при помощи лапа-роцентеза?
Асцит легко обнаруживается
при скоплении в брюшной полости большого количества жидкости. Если после
объективного обследования диагноз асцита представляется спорным, выполняют
ультразвуковое исследование, посредством которого определяют также и причину
асцита (например паренхиматозное поражение печени, спле-номегалию и расширение
воротной вены). Диагностический лапароцентез — простой и безопасный метод,
а исследование асцитической жидкости помогает дифференцировать асцит от
других заболеваний. Более чем у 30 % пациентов с циррозом печени и асцитом
отмечается инфицирование асцитической жидкости до поступления в стационар
или после госпитализации в клинику. Тем не менее плановый диагностический
лапароцентез показан: (1) всем пациентам с впервые выявленным асцитом;
(2) пациентам, поступившим в стационар. Отметим, что лапароцентез необходимо
повторить, если во время пребывания в стационаре состояние пациента ухудшается,
особенно при присоединении признаков бактериальной инфекции.
3. Как выполняют диагностический
лапароцентез?
Несмотря на то что лапароцентез
— простая и безопасная манипуляция, при его выполнении необходимо принимать
определенные меры предосторожности во избежание развития осложнений. Первое
и непременное условие — стерильность. Кожу живота моют и обрабатывают раствором
йода. Хирург надевает стерильные перчатки. Прокол производят в области
притупления перкуторного звука, предпочтительно по средней линии между
пупком и лобковым симфизом (т. е. в бессосудистой зоне). Кроме того, прокол
следует осуществлять в стороне от послеоперационных рубцов, поскольку в
них могут быть коллатеральные сосуды и спайки с кишками. Для исследования
необходимо забрать 30-50 мл асцитической жидкости. После лапароцентеза
пациента на 10-30 мин укладывают так, чтобы предотвратить истечение асцитической
жидкости.
4. Какие анализы асцитической
жидкости выполняют в плановом порядке?
Исследование асцитической
жидкости имеет своей целью выяснение причин асцита. Однако выполнять весь
перечень тестов каждому больному нет необходимости. К главным тестам относятся
подсчет клеточных элементов, бактериологический посев, определение концентрации
альбумина и общего белка.
Самый важный анализ — определение
количества
лейкоцитов, поскольку благодаря ему можно быстро получить сведения
о присоединении бактериальной инфекции. Абсолютное число нейтрофилов
=> 250 клеток/мм3 свидетельствует о бактериальном инфицировании
асцитической жидкости и требует эмпирического лечения антибиотиками. Повышение
числа лейкоцитов с преобладанием лимфоцитов указывает на наличие у пациента
карциноматоза брюшины или туберкулезного перитонита. Определение концентрации
альбумина позволяет вычислить его градиент между сывороткой и асцитической
жидкостью и классифицировать на низкий и высокий (см. вопрос 5 данной главы).
Посев асцитической жидкости
осуществляется у постели больного в специальные бутылочки или пробирки,
предназначенные для посева крови. Чувствительность этого метода достаточно
высока. Если у больного на основании клинических признаков подозревается
туберкулезный перитонит, а число лейкоцитов в асцитической жидкости повышено
преимущественно за счет лимфоцитов, показан посев асцитической жидкости
на специальные питательные среды.
Определение концентрации
общего белка в асцитической жидкости используется для отнесения ее
к транссудатам и экссудатам. В настоящее время эта классификация не имеет
большого значения, поскольку асцит при циррозе печени является экссудатом
более чем в 30 % случаев. Тем не менее определение концентрации общего
белка в асцитической жидкости остается обязательным тестом, т. к. помогает
выявить пациентов, входящих в группу высокого риска по развитию спонтанного
бактериального перитонита (СБП) (общий белок < 10 г/л), а также дифференцировать
спонтанный бактериальный перитонит от вторичного. Определение уровня глюкозы
и лактатдегидрогеназы (ЛДГ) в асцитической жидкости — весьма полезный
дифференциально-диагностический метод (см. вопрос 9 данной главы). Значительное
повышение активности амилазы в асцитической жидкости отмечается
у пациентов с панкреатическим асцитом и перфорацией кишки на фоне асцита.
Окрашивание
асцитической жидкости по Граму обычно дает отрицательный результат
при циррозе и на ранних стадиях спонтанного бактериального перитонита.
Однако при помощи данного метода выявляют пациентов с перфорацией кишки,
у которых в асцитической жидкости обнаруживается множество различных типов
бактерий. Цитологическое исследование асцитической жидкости информативно
при асците, обусловленном злокачественными новообразованиями, с вовлечением
в патологический процесс брюшины. К сожалению, этот метод не позволяет
диагностировать пече-ночно-клеточный рак, при котором метастазирование
в брюшину происходит редко. Ценность других тестов, считавшихся полезными
для диагностики асцита, обусловленного злокачественными новообразованиями
(определение в асцитической жидкости уровня фибронектина, холестерина и
карциноэмбрионального антигена), в настоящее время невелика.
5. В чем заключается польза
определения градиента концентрации альбумина между сывороткой крови и асцитической
жидкостью?
Градиент концентрации альбумина
между сывороткой крови и асцитической жидкостью — более важный тест для
классификации асцита, чем концентрация общего белка в асцитической жидкости.
Сывороточно-асцитический градиент альбумина физиологически основан на онкотическо-гидростатическом
соотношении и напрямую зависит от давления в воротной вене. Он определяется
разностью концентрации альбумина в асцитической жидкости и концентрации
альбумина в сыворотке крови (данные должны быть получены в один и тот же
день). У пациентов с градиентом > 11 г/л имеется портальная гипертензия,
у пациентов с градиентом < 11 г/л давление в воротной вене нормальное.
6. Каковы причины высокого
(>
ii г/л) сывороточно-асцитического градиента альбумина?
Самая частая причина высокого
сывороточно-асцитического градиента альбумина — цирроз печени. К другим
возможным причинам, приводящим к повышению давления в системе воротной
вены, относятся алкогольный гепатит, сердечная недостаточность, множественные
метастазы в печень, молниеносная печеночная недостаточность, синдром Бадда-Киари,
тромбоз воротной вены, облитерирующий эндофлебит (первичный тромбоз) печеночных
вен, микседема, жировая дистрофия печени беременных и так называемый "смешанный"
асцит. Развитие "смешанного" асцита обусловлено как минимум двумя причинами,
по одной из которых происходит повышение давления в системе воротной вены
(например цирроз печени и туберкулезный перитонит).
7. Каковы причины низкого
(< 11 г/л) сывороточно-асцитического градиента альбумина?
Асцит с низким сывороточно-асцитическим
градиентом концентрации альбумина наблюдается при отсутствии портальной
гипертензии и, как правило, обусловлен поражением брюшины. Наиболее частая
его причина — карциноматоз брюшины. К другим причинам относятся туберкулезный
перитонит, заболевания поджелудочной железы, билиарный асцит, нефротический
синдром, серозит, а также кишечная непроходимость или гангрена кишки.
8. Перечислите разновидности
инфицированных асцитов.
Инфицирование асцитической
жидкости может быть спонтанным или вторичным (при наличии внутрибрюшного,
поддающегося хирургическому лечению источника инфекции). У пациентов с
циррозом печени инфицирование асцитической жидкости более чем в 90 % случаев
происходит самопроизвольно. За последнее десятилетие на основании особенностей
бактериальной флоры, высеваемой из асцитической жидкости, и числа полиморфно-ядерных
лейкоцитов (ПМЯЛ) у больных с циррозом печени описано три варианта инфицированного
асцита. При спонтанном бактериальном перитоните (СПБ) наблюдается рост
бактериальной флоры (культуроположительный) при посеве на питательные среды
(обычно это моноинфекция) и число полиморфноядерных клеток в асцитической
жидкости > 250 клеток/мм3. Диагноз культуроотрицательного нейтрофильного
асцита ставится в том случае, если число полиморфно-ядерных клеток превышает
250 клеток/мм3, а рост бактериальной флоры отсутствует. Бактериальный
асцит характеризуется числом полиморфно-ядерных клеток менее 250 клеток/мм3
и ростом бактериальной флоры (моноинфекция).
9. Как дифференцировать
спонтанный бактериальный перитонит от вторичного?
У пациентов с циррозом печени
необходимо дифференцировать спонтанный бактериальный перитонит от вторичного,
т. к. лечение спонтанного перитонита консервативное, а вторичного, как
правило, хирургическое. Несмотря на то что на долю вторичного перитонита
приходится менее 10 % случаев инфицирования асцитической жидкости, возможность
его развития следует предполагать у всех пациентов с нейтрофиль-ным асцитом.
При дифференцировании этих двух состояний помогает анализ асцитической
жидкости. Вторичный бактериальный перитонит нужно подозревать тогда, когда
при исследовании асцитической жидкости обнаруживаются два или три из следующих
критериев: (1) концентрация общего белка > 10 г/л; (2) глюкозы <
500 мг/л; (3) ЛДГ >225 мЕ/мл (или выше верхней границы нормы для
сыворотки крови). При. посеве асцитической жидкости у большинства таких
пациентов выявляется полиинфекция, в то время как у больных со спонтанным
бактериальным перитонитом — моноинфекция. Пациентам с подозрением на вторичный
бактериальный перитонит требуется в экстренном порядке выполнить необходимые
рентгенологические исследования с целью подтверждения диагноза и обнаружения
локализации возможной перфорации полого органа. Если причиной возникновения
вторичного бактериального перитонита послужила не перфорация полого органа,
указанные критерии менее информативны, однако у данных пациентов число
полиморфно-ядерных клеток через 48 ч после начала лечения по сравнению
с исходным повышается, а из асцитической жидкости продолжает высеваться
бактериальная флора. При правильной тактике лечения у пациентов со спонтанным
бактериальным перитонитом, напротив, число полиморфно-ядерных клеток быстро
снижается, а высевание микрофлоры из асцитической жидкости прекращается.
Виды инфицированного асцита в зависимости
от особенностей асцитической жидкости
|
|
ПОСЕВ АСЦИТИЧЕСКОЙ
ЖИДКОСТИ
|
КОЛИЧЕСТВО
ПОЛИМОРФНО-ЯДЕРНЫХ КЛЕТОК в 1 мм3
|
|
Спонтанный
бактериальный перитонит
|
Положительный
|
=>250
|
|
Культуроотрицательный
нейтрофильный асцит
|
Отрицательный
|
=>250
|
|
Мономикробный
ненейтрофильный бактериальный асцит
|
Положительный
|
<250
|
10. Кто входит в группу
высокого риска по развитию спонтанного бактериального перитонита?
• Пациенты с циррозом печени
и желудочно-кишечным кровотечением.
• Пациенты с циррозом печени,
асцитом и низкой концентрацией общего белка в асцитической жидкости (<
10 г/л).
• Пациенты с циррозом печени
и спонтанным бактериальным перитонитом в анамнезе.
• Пациенты с молниеносной
печеночной недостаточностью.
11. Каков патогенез спонтанного
бактериального перитонита?
Грамотрицательные бактерии,
в норме присутствующие в желудочно-кишечном тракте, чаще всего и вызывают
развитие спонтанного бактериального перитонита у пациентов с циррозом печени.
Возможность прямого попадания бактерий желудочно-кишечного тракта в кровь
воротной вены или асцитическую жидкость (если целостность слизистой оболочки
кишки не нарушена) у пациентов с циррозом печени не доказана. Недавний
эксперимент на крысах с циррозом печени и асцитом продемонстрировал, что
жизнеспособные бактерии попадают из желудочно-кишечного тракта в мезентериальные
лимфатические узлы. Нарушения иммунного статуса, а особенно уменьшение
активности ретикулоэндотелиальной системы и низкий уровень комплемента
в сыворотке, часто приводят к длительной бактериемии и колонизации жидких
сред организма (в т. ч. асцитической жидкости). Развитие бактериальной
инфекции зависит от способности асцитической жидкости уничтожать бактерии.
In
vitro бактерицидная активность асцитической жидкости напрямую связана
с концентрацией в ней общего белка и фракции СЗ комплемента. У пациентов
с циррозом печени и низкой бактерицидной активностью асцитической жидкости
концентрация в ней фракции СЗ комплемента и общего белка низкая, следовательно,
вероятность возникновения спонтанного бактериального перитонита высокая.
У пациентов с высокой бактерицидной активностью асцитической жидкости концентрация
в ней фракции СЗ комплемента и общего белка высокая, значит, бактериальная
колонизация у них может разрешиться спонтанно.
12. Какой простой тест
позволяет осуществлять раннюю диагностику инфицированного асцита?
Решение о назначении эмпирической
антибиотикотерапии необходимо принимать максимально быстро, т. к. выживаемость
пациентов зависит от ранней диагностики и своевременного начала лечения.
При окраске мазка по Граму положительный результат наблюдается лишь у 5-10
% пациентов; при этом рост бактериальной флоры становится заметным не менее
чем через 12ч после посева. Подсчет числа нейтрофилов в асцитической жидкости
— высокочувствительный метод определения ее инфицирования, занимающий всего
несколько минут. Сразу после пункции асцитическую жидкость во избежание
свертывания помещают в сосуд, содержащий антикоагулянт. Другие несложные
тесты, такие как определение рН асцитической жидкости или градиента рН
асцитической жидкости и артериальной крови, а также определение содержания
лактата в асцитической жидкости и градиента лактата в асцитической жидкости
и в сыворотке крови, обладают гораздо меньшей чувствительностью, чем подсчет
числа нейтрофилов.
13. Назовите препараты
выбора при лечении пациентов с подозрением на спонтанный бактериальный
перитонит.
Раньше при подозрении на
развитие спонтанного бактериального перитонита назначали антибиотики широкого
спектра действия, например аминогликозиды в сочетании с ампициллином. При
этом у многих пациентов с циррозом печени аминогликозиды оказывали выраженное
нефротоксическое действие, даже если осуществлялся контроль их уровня в
сыворотке крови. На цефалоспорины третьего поколения реагируют большинство
микроорганизмов, вызывающих спонтанный бактериальный перитонит; цефалоспорины
гораздо эффективнее, чем аминогликозиды в сочетании с ампициллином, и обладают
меньшей нефротоксичностью. При подозрении на спонтанный бактериальный перитонит
следует начинать лечение цефотаксимом или другими цефалоспоринами. Недавние
исследования продемонстрировали, что внутривенное введение цефотаксима
в дозе 2,0 г каждые 8-12 ч так же действенно, как и введение препарата
каждые 6 ч, а кроме того, точно определили необходимую продолжительность
курса антибиотикотерапии, показав при этом, что короткий курс (5 дней)
так же эффективен, как и более продолжительный (10 дней).
14. Когда начинают антибиотикотерапию
у пациентов с циррозом печени и подозрением на инфицирование асцитической
жидкости?
Эмпирическое лечение антибиотиками
начинают в возможно более ранние сроки с целью повышения выживаемости пациентов.
Поэтому при появлении у стационарного больного с асцитом клинических признаков
возможной инфекции (лихорадки, болей в животе, энцефалопатии) или в случае
ухудшения клинических симптомов или лабораторных показателей необходимо
выполнить стандартное бактериологическое исследование асцитической жидкости,
крови, мочи и мокроты, а также подсчет числа полиморфно-ядерных клеток
в асцитической жидкости. Исследование асцитической жидкости и мочи обязательно
производят при поступлении пациента с циррозом печени и асцитом в стационар,
т. к. в 20 % случаев инфицирование асцитической жидкости происходит именно
в это время. По отношению к таким пациентам оправдана высокая настороженность
в связи с присоединением бактериальной инфекции, которая часто становится
причиной ухудшения состояния пациента и смерти. При подозрении на инфицирование
асцитической жидкости или при выявлении в ней более 250 нейтрофилов в 1
мм3 назначают антибиотики сразу после посева асцитической жидкости
на питательные среды и выполнения необходимых анализов (см. схему лечения
больных со спонтанным бактериальным перитонитом).
15. Является ли бактериальный
асцит истинной перитонеальной инфекцией? Нужно ли его лечить?
Недавние исследования показали,
что мономикробный ненейтрофильный бактериальный асцит характеризуется непродолжительным
естественным течением. При повторном лапароцентезе у пациентов с бактериальным
асцитом (до начала антибио-тикотерапии) было выявлено, что в 62-86 % случаев
он разрешается самостоятельно. Отметим, что у всех пациентов, у которых
развивался спонтанный бактериальный перитонит, имелись клинические симптомы
бактериальной инфекции во время выполнения первого лапароцентеза. Этот
факт свидетельствует, что бактериальный асцит — это динамический процесс
и его развитие зависит от нескольких факторов, включая иммунный статус
пациента, бактерицидную активность асцитической жидкости, а также вирулентность
микроорганизмов. В соответствии с результатами проведенных исследований
больные с симптоматическим бактериальным асцитом нуждаются в антибиотикотерапии.
В случае бессимптомного течения заболевания антибиотики не назначают, но
проводят повторный лапароцентез. Если число полиморфно-ядерных лейкоцитов
в асцитической жидкости превышает 250/мм3, показан курс антибиотикотерапии.
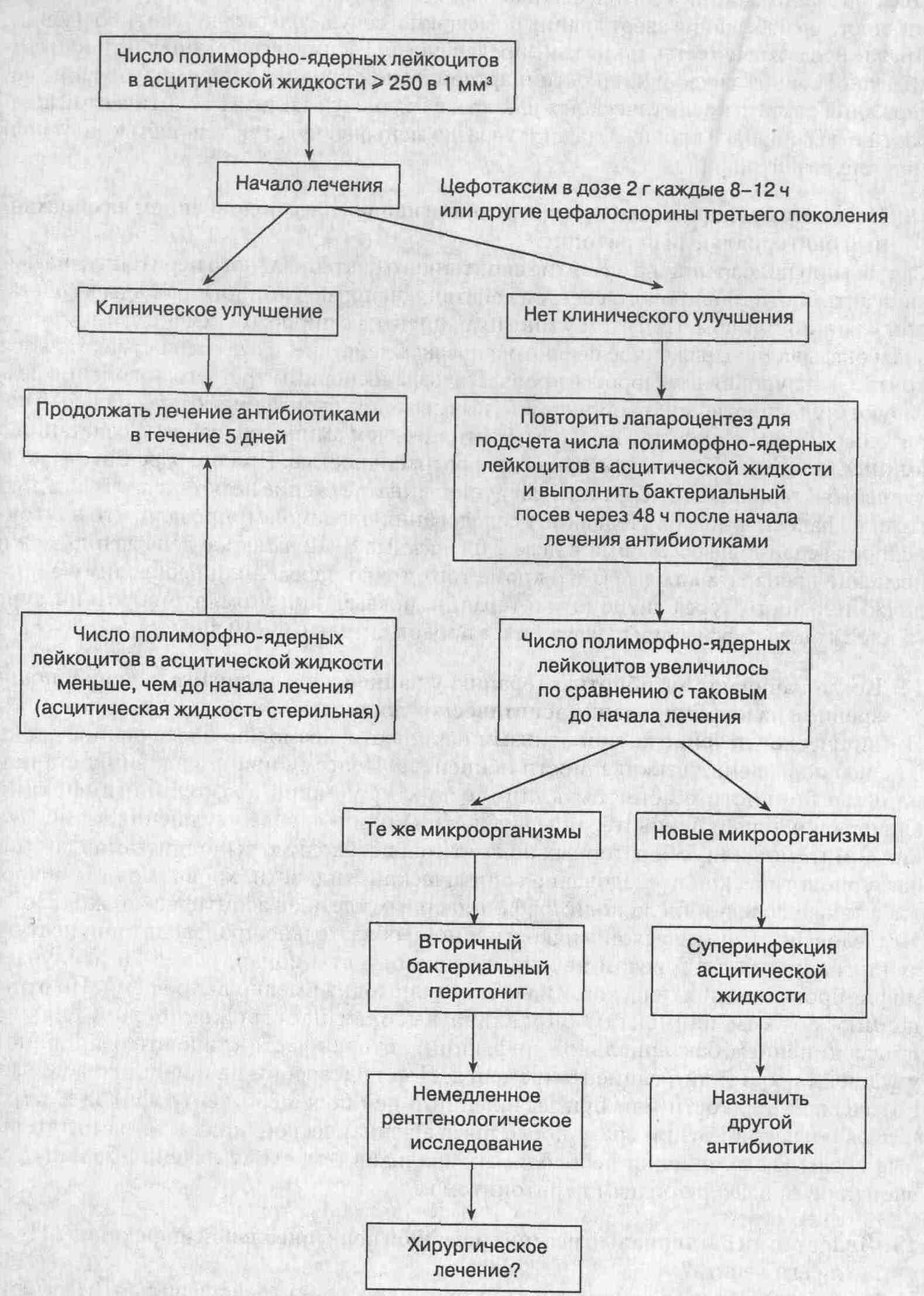
Схема лечения пациентов со спонтанным
бактериальным перитонитом
16. Необходим ли постоянный
контроль числа полиморфно-ядерных лейкоцитов в асцитической жидкости во
время лечения пациентов со спонтанным бактериальным перитонитом?
У 86 % пациентов со спонтанным
бактериальным перитонитом после введения одной только дозы цефотаксима
высеять возбудитель из асцитической жидкости невозможно. В 90 % случаев
при этом отмечается также быстрое снижение числа нейтрофилов до нормальных
величин. Развитие суперинфекции или раннее рецидивирование заболевания
после лечения цефалоспоринами третьего поколения встречается крайне редко.
Если у пациента имеется хороший эффект от проводимой терапии, в повторном
лапароцентезе необходимости нет.
17. Каким пациентам с
заболеваниями печени необходимо проводить лечение с целью предотвращения
развития бактериальной инфекции?
Поскольку кишечные аэробные
грамотрицательные бактерии являются наиболее частыми возбудителями, вызывающими
развитие инфекционного процесса у пациентов с циррозом печени, а их миграция
— важным звеном патогенеза, подавление кишечной грамотрицательной микрофлоры
оказывается эффективным методом профилактики бактериальных инфекций. Пациентам
с заболеваниями печени и высоким риском возникновения бактериальной инфекции
и/или спонтанного бактериального перитонита показана так называемая выборочная
санация кишечной микрофлоры (ВСКМФ). ВСКМФ заключается в подавлении роста
грамотрицательной микрофлоры кишки с сохранением грамположительных кокков
и анаэробов. Сохранение анаэробной микрофлоры необходимо для предотвращения
избыточной колонизации кишки, чрезмерного роста и последующего распространения
патогенных бактерий. По данным исследований, ВСКМФ при помощи норфлоксацина,
принимаемого внутрь, эффективно препятствует развитию бактериальной инфекции
и/или спонтанного бактериального перитонита у находящихся на стационарном
лечении пациентов с циррозом печени и (1) желудочно-кишечным кровотечением
(400 мг 2 раза в день); (2) низкой концентрацией белка в асцитической жидкости
(400 мг/день); (3) с молниеносной печеночной недостаточностью (400 мг/день).
Согласно результатам тех же исследований, короткий профилактический курс
норфлоксацина (по 400 мг/день) предотвращает рецидивы спонтанного бактериального
перитонита, в связи с чем некоторые авторы считают проведение длительного
курса лечения нецелесообразным. Окончательное решение этой проблемы требует
дальнейших исследований. Тем не менее у больных с циррозом печени, перенесших
спонтанный бактериальный перитонит, следует обсудить возможность пересадки
печени; в предоперационном периоде таким пациентам показана терапия норфлокса-цином.
18. Почему так важно знать, каков баланс
натрия у пациентов с циррозом печени и асцитом?
У пациентов с циррозом печени
асцит возникает вследствие задержки в организме почками ионов натрия и
воды. Цель консервативной терапии асцита у таких больных — выведение из
организма накопившейся жидкости путем создания отрицательного баланса натрия.
Ее можно достигнуть, уменьшив прием натрия с пищей и увеличив его выделение
с мочой. Знание уровня выведения натрия позволяет врачу правильно подобрать
терапию. В дополнение отметим, что по уровню выведения из организма натрия
легко определить прогноз заболевания. У пациентов с циррозом печени и выделением
натрия с мочой в количестве менее 10 мэкв/сут двухлетняя выживаемость составляет
20 %, а у пациентов с суточным выделением натрия более 10 мэкв - 60 %.
19. С чего начинают лечение пациентов
с циррозом печени и асцитом?
Лечение пациентов с циррозом
печени и асцитом следует начинать с назначения ди-уретиков и ограничения
приема натрия с пищей до 50-88 мэкв/сут. Более выраженное ограничение поступления
в организм соли нередко приводит к усилению ано-рексии и недостаточности
питания. Ограничивать прием воды, как правило, не требуется, если концентрация
натрия в сыворотке превышает 120 мэкв/л. Отрицательного баланса натрия
в 15-20 % достигают, не прибегая к диуретикам, а только ограничивая
его поступление в организм. Однако, поскольку 80-85 % пациентов ди-уретики
необходимы, целесообразно назначать их всем больным. Начальная доза — 100
мг/сут спиронолактона и 40 мг/сут фуросемида внутрь. Оптимальные дозы препаратов
подбирают с учетом изменения суточного выделения натрия и веса пациента.
Дозы диуретиков увеличивают до тех пор, пока не достигают отрицательного
баланса натрия (т. е. пока выделение натрия не станет превышать его поступление
в организм). Максимальные дозы спиронолактона и фуросемида составляют 400
мг/сут и 160 мг/сут соответственно. После ликвидации асцита пациентам назначают
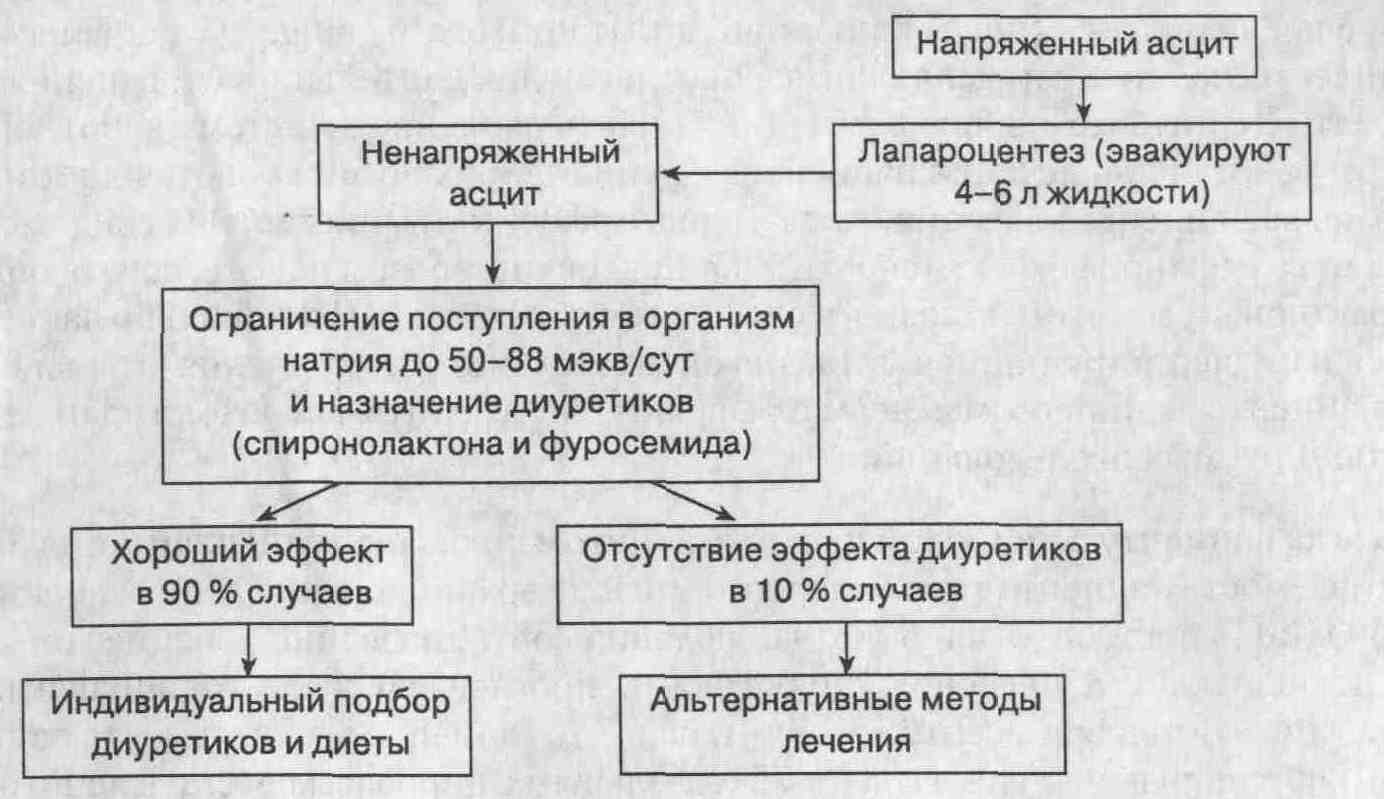
поддерживающие дозы диуретиков для профилактики его рецидива. Пациентам
с напряженным асцитом в первую очередь показан лечебный лапароцентез (эвакуация
4 л жидкости и более).
20. Что такое рефрактерный (устойчивый)
асцит?
Рефрактерный (устойчивый)
асцит характеризуется отсутствием эффекта от ограничения приема соли и
назначения диуретиков в высоких дозах; при этом масса тела пациента не
снижается, а при введении диуретиков не исключено развитие осложнений.
Прежде чем поставить диагноз рефрактерного асцита, необходимо исключить
наличие следующих факторов: (1) избыточный прием натрия; (2) бактериальная
инфекция; (3) скрытое желудочно-кишечное кровотечение; (4) прием ингибиторов
про-стагландинов (например аспирина). Менее чем у 10 % пациентов с циррозом
печени отсутствует эффект от традиционной (обычной) медикаментозной терапии.
У них следует обсудить возможность применения других методов лечения, таких
как пересадка печени, хронический лапароцентез (выполняемый амбулаторно
каждые 2 недели), наложение перитонеовенозного шунта, введение трансяремного
портокаваль-ного стента (ТВПШ).
Начальное лечение пациентов с цирозом
печени и асцитом
21. Кому показано удаление большого
количества асцитической жидкости (лечебный лапароцентез) ?
Удаление большого количества
асцитической жидкости — старый, но безопасный и эффективный способ ликвидации
асцита у больных с циррозом печени. Интерес к этой манипуляции возобновился
в прошедшее десятилетие. Недавние исследования показали, что лечебный лапароцентез
не только безопасен — он также положительно влияет на гемодинамику у пациентов
с напряженным асцитом. Однако неоднократное удаление большого количества
асцитической жидкости приводит к снижению в ней концентрации белка и, теоретически,
является предрасполагающим фактором развития спонтанного бактериального
перитонита. Поэтому лечебный лапароцентез не следует выполнять в плановом
порядке всем пациентам с циррозом печени и асцитом; он показан только при
напряженном и/или рефрактер-ном асците.
22. Каковы показания к наложению перитонеовенозного
шунта в наши дни?
В 1974 г. Ле Вин (Le Veen)
и соавт. предложили наложение перитонеовенозного шунта для лечения пациентов
с циррозом печени и напряженным асцитом. Однако их первоначальный энтузиазм
быстро угас после сообщений о многочисленных осложнениях этой операции.
Число осложнений было особенно велико у пациентов с выраженной печеночно-клеточной
недостаточностью. Наложение перитонеовенозного шунта не снижало смертность
среди первично госпитализированных больных и не увеличивало отдаленную
выживаемость у больных с циррозом печени. Наложение перитонеовенозного
шунта показано пациентам с циррозом печени и рефрактерным асцитом, которым
не планируется выполнение пересадки печени, а эвакуация у них большого
количества асцитической жидкости затруднительна.
23. Каким пациентам с циррозом печени
и асцитом показано ТВПШ?
Трансяремное внутрипеченочное
портокавальное шунтирование (установка стента) является инвазивной манипуляцией,
выполняемой под рентгенологическим контролем. ТВПШ заключается в создании
сообщения между печеночной и воротной венами с последующим (после баллонной
дилатации этого свища) установлением металлического стента с изменяющимся
просветом для длительного сохранения проходимости. Данный метод, позволяющий
снизить давление в системе воротной вены, был разработан для лечения пациентов
с рецидивирующими кровотечениями из варикозно расширенных вен пищевода.
Первые результаты применения свидетельствуют о его возможной эффективности
у пациентов с циррозом печени, сочетающимся с рефрактерным асцитом. Однако,
в связи с тем что при ТВПШ довольно часто встречается нарушение функций
шунта, для окончательного определения его роли в лечении пациентов с циррозом
печени и рефрактерным асцитом необходимо проведение контролируемых исследований.
24. Когда пациенту с циррозом печени
и асцитом показана трансплантация печени?
Выживаемость пациентов после
первого эпизода возникновения асцита оценивается как 50 и 20 % после 1
года и 5 лет наблюдения соответственно. У пациентов с асцитом, не поддающимся
лечению диуретиками, прогноз еще хуже: годичная выживаемость у них составляет
всего 25 %. Учитывая, что годичная выживаемость пациентов после пересадки
печени превышает 75 %, больным с циррозом печени и асцитом, особенно не
реагирующим на терапию диуретиками, показана трансплантация печени. Следует
учесть, что у некоторых больных, злоупотребляющих алкоголем и страдающих
рефрактерным асцитом, можно получить хороший эффект от лечения диуретиками
после нескольких месяцев воздержания от приема алкоголя.
25. Необходимо ли переливание растворов
для увеличения объема циркулирующей крови после эвакуации большого количества
асцитической жидкости?
Вопрос о необходимости увеличения
объема циркулирующей плазмы после удаления большого количества асцитической
жидкости остается спорным. Растворы, позволяющие увеличить объем циркулирующей
крови, используют для предотвращения нарушений гемодинамики, которые, теоретически,
могут возникать у пациентов с циррозом печени, перенесших лечебный лапароцентез
(т. е. после эвакуации 5 л и более асцитической жидкости). По результатам
одного исследования, у пациентов, которым после парацентеза вводили альбумин,
гипонатрийемия и азотемия были менее выражены, чем у больных, такового
не получавших. Тем не менее инфузии альбумина не уменьшали число осложнений
и повторных госпитализаций и не увеличивали выживаемость пациентов. Учитывая
высокую стоимость альбумина, некоторые исследователи предприняли попытки
использования других препаратов, увеличивающих объем плазмы. Для окончательного
решения этой проблемы необходимо ее дальнейшее изучение. В настоящее время
инфузионную терапию следует рассматривать как необязательную до тех пор,
пока не будет доказано, что она снижает длительность лечения и увеличивает
выживаемость у пациентов, перенесших лечебный лапароцентез.