ГЛАВА 25. СОСУДИСТЫЕ ЗАБОЛЕВАНИЯ
ПЕЧЕНИ
1. Каковы наиболее важные
особенности сосудистой анатомии печени?
Масса печени составляет 5
% от массы тела взрослого человека. К печени по печеночной артерии и воротной
вене поступает 20 % общего объема сердечного выброса. Печеночная артерия
отходит
от чревного ствола. Она обеспечивает примерно 30 % афферентного кровотока,
но доставляет к органу более 50 % кислорода, утилизируемого в состоянии
покоя.
Воротная вена не
имеет клапанов, обеспечивает 70-80 % общего печеночного кровотока и доставляет
немногим менее 50 % необходимого кислорода. Она формируется на уровне поджелудочной
железы при слиянии селезеночных вен и верхней брыжеечной вены. В воротах
печени воротная вена и печеночная артерия делятся на правые и левые ветви
и далее разветвляются в соответствии с анатомическим строением печени.
Кровь из печеночных артериол и воротных венул поступает в синусоиды. На
этом уровне в печеночных артериях расположены сфинктеры, регулирующие интенсивность
кровотока. Сфинктеры есть и в синусоидах, они осуществляют регуляцию кровотока
и распределение крови, а потому играют важную роль, регулируя поступление
крови по печеночной артерии. Уменьшение поступления крови по воротной вене
приводит к немедленному усилению кровотока по печеночной артерии. Несмотря
на это, кровоток по воротной вене относительно стабилен и мало зависит
от кровотока в печеночной артерии. Из синусоидов кровь поступает в центральные
венулы, формирующие печеночные ве-нулы. Существуют три основные печеночные
вены: правая, средняя и левая. Их ветви распределяются в паренхиме
печени совершенно по-иному, нежели ветви печеночной артерии и воротной
вены, чем и объясняется отличие хирургической и сосудистой анатомии печени
от макроскопической (которая представлена четырьмя долями — правой, левой,
хвостатой и квадратной). Сосудистая анатомия печени описана Куино (Coinaud).
По Куино, печень состоит из 8 сегментов (см. рисунок).
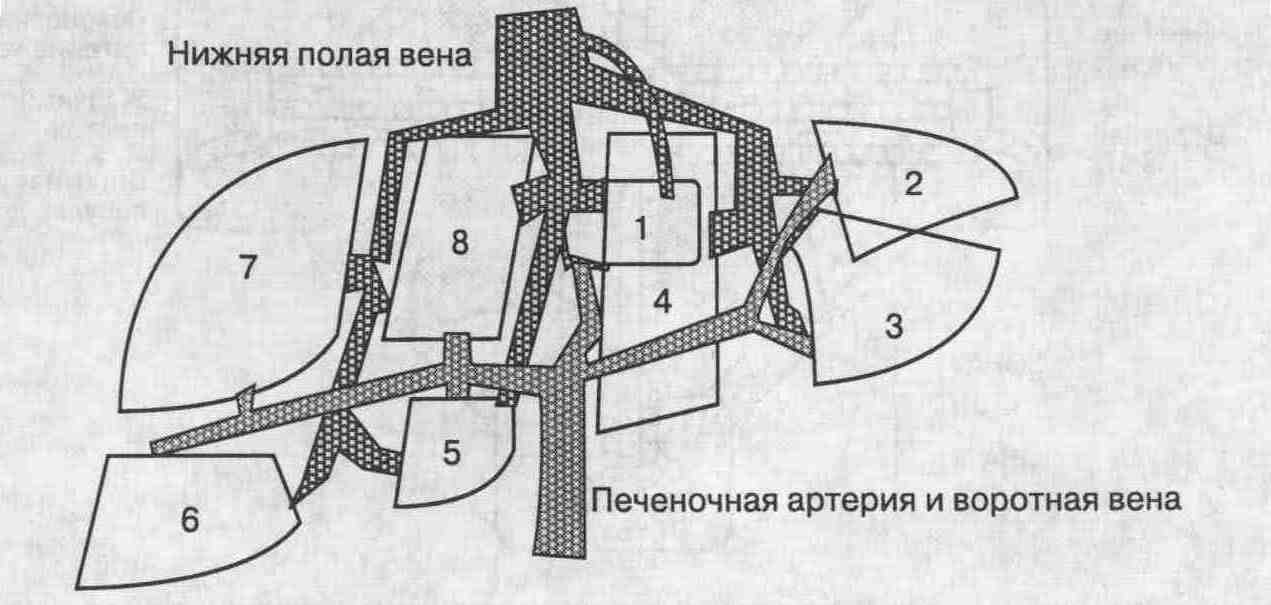
Сосудистая и хирургическая анатомия
печени. По Куино, в печени выделяется 8 функциональных сегментов. Эти сегменты
получают кровь как из воротной вены, так и из печеночной артерии. Отток
крови осуществляется через правую, левую и среднюю печеночные вены. Кровь
от хвостатой доли (сегмент 1) по дорсальным печеночным венам оттекает непосредственно
в нижнюю полую вену. Сосудистое строение печени необходимо учитывать при
выполнении ее резекции
Каждый из сегментов имеет
свое афферентное и эфферентное кровоснабжение. Это следует учитывать при
резекции печени. Также важно знать, что отток крови от хвостатой доли печени
осуществляется по дорсальным печеночным венам (количество которых может
быть различным), впадающим непосредственно в нижнюю полую вену. Этим объясняется
компенсаторная гипертрофия хвостатой доли печени при синдроме Бадда-Киари.
2. Опишите микроархитектонику
печени, включая систему микроциркуляции.
Основной структурный элемент
печени — печеночная клеточная пластинка (печеночная долька - примеч.
ред.) (см. рисунок). Она состоит из 15-20 гепатоцитов и располагается
между портальной зоной и печеночными венулами. Гепатоциты, примыкающие
к печеночным венулам, называются перивенулярными или перицентральными.
Перивенулярные гепатоциты испытывают наибольшую гипоксию, т. к. крово-снабжаются
в последнюю очередь (ток крови по синусоидам происходит всегда в одном
направлении, а перивенулярные гепатоциты находятся "в конце пути").
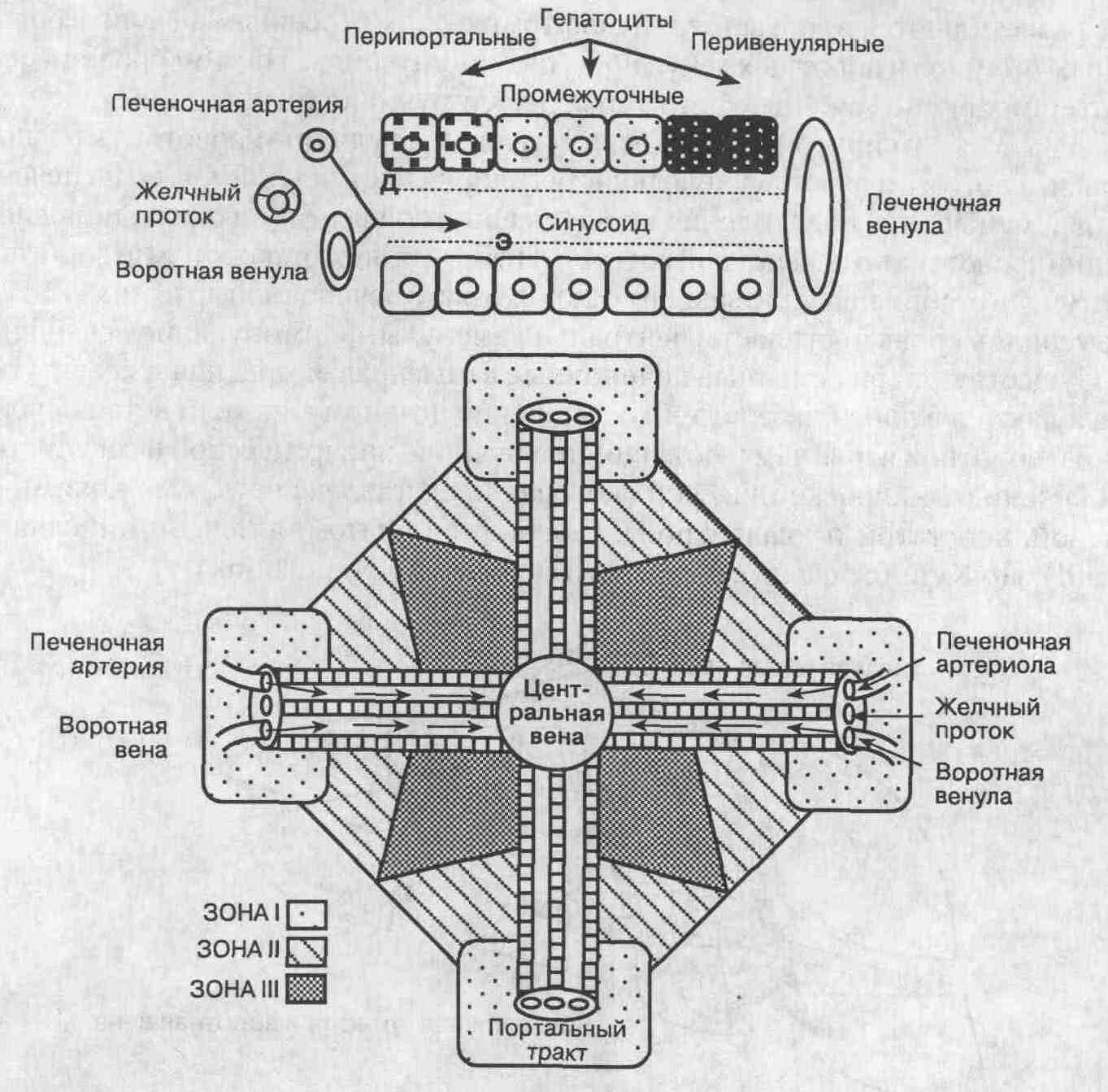
Микроархитектоника печени. Кровь из
воротных венул и печеночных артериол поступает в синусоиды, а из них —
в печеночные венулы. Низкое давление крови в синусоидах обеспечивает условия
для выхода плазмы через фенестры эндотелия в пространство Диссе, где происходит
прямой контакт с гепатоцитами, обмен питательных веществ и метаболитов.
Гепатоциты, расположенные около портальной триады, называются перипортальными,
а около печеночных венул — перивенулярными
При нарушении оттока крови
от печени (облитерирующий эндофлебит печеночных вен или синдром Бадда-Киари)
в первую очередь повреждаются перивенулярные гепатоциты. Исходя из концепции
строения печеночной дольки, предложенной Рап-папортом (Rappaport), эта
область известна как зона III. Зона I представлена перипортальными гепатоцитами,
расположенными вблизи портальной области, а зона II — промежуточными гепатоцитами,
которые локализуются между перипортальными и перивенулярными гепатоцитами.
Четких границ между зонами не существует. Метаболические функции клеток,
так же как и чувствительность к повреждению, меняются в зависимости от
места их расположения. Гепатоциты зоны II и III участвуют в метаболизме
лекарственных средств и содержат значительное число ферментов комплекса
цитохрома Р450, в связи с чем токсические эффекты ме-таболизируемых этими
микросомальными ферментами препаратов менее выражены в зоне I.
3. Что такое синдром Бадда-Киари,
и при каких заболеваниях он развивается?
Синдром Бадда-Киари — это
тромбоз печеночных вен. Он может развиться у пациентов с травмой живота;
миелопролиферативными синдромами; пароксизмальной ночной гемоглобинурией;
системной красной волчанкой; заболеваниями, сопровождающимися дефицитом
противосвертывающих факторов, антитромбина III, протеина С и S; опухолями
поджелудочной железы, надпочечников и почек; печеночно-клеточным раком,
а также у беременных женщин и пациентов, принимающих препараты, повышающие
свертываемость крови (пероральные контрацептивы и дакарбазин). У 25-30
%
пациентов никаких сопутствующих заболеваний диагностировать не удается
(в таком случае синдром Бадда-Киари называют "идиопатическим").
4. Каковы симптомы и жалобы
у пациентов с синдромом Бадда-Киари?
• Асцит — обнаруживается
более чем у 90 % пациентов; является основным проявлением синдрома Бадда-Киари.
•Боль в животе —
возникает у 80 % пациентов; локализуется в правом подреберье.
• Гепатоспленомегалия
—
встречается часто.
• Желтуха — выражена незначительно;
может отсутствовать.
• Печеночная энцефалопатия
и кровотечение из варикозно расширенных вен пищевода и желудка — диагностируется
менее часто (в 10-20 % случаев) и наблюдается, как правило, у пациентов
с далеко зашедшими стадиями заболевания.
5. Каковы методы диагностики
синдрома Бадда-Киари?
У 75 % больных диагноз ставится
по результатам допплеровского ультразвукового исследования печеночных
вен. При этом могут выявляться гиперэхогенный тромб в просвете сосуда,
уменьшение или отсутствие кровотока или гиперэхогенный тяж (полоса) на
месте одной (или более) главных печеночных вен. Гипертрофированную хвостатую
долю печени нетрудно ошибочно расценить как опухоль. "Золотой стандарт"
диагностики заболевания — катетеризация печеночной вены и ангиография.
Этот
метод характеризуется высокой чувствительностью и специфичностью, а при
остром синдроме Бадда—Киари используется для введения в тромбированные
вены стрепто-киназы. В настоящее время изучается магнитно-резонансная
ангиография, которая может стать весьма полезным неинвазивным методом
диагностики синдрома Бадда-Киари.
6. Почему у некоторых
пациентов с синдромом Бадда-Киари обнаруживается увеличение хвостатой доли
печени?
Примерно у 50 % пациентов
с синдромом Бадда-Киари наблюдается компенсаторная гипертрофия хвостатой
доли печени. Причина этого состоит в том, что отток от хвостатой доли осуществляется
по собственным, дорсальным, венам печени, впадающим непосредственно в нижнюю
полую вену. Если окклюзия происходит ниже уровня этих вен, они остаются
свободно проходимыми, в то время как основные печеночные вены тромбируются.
Хвостатая доля печени гипертрофируется, чтобы компенсировать уменьшение
функциональной паренхимы печени. Гипертрофия может быть значительной и
давать характерное вдавление на флебограмме нижней полой вены.
7. Какова характерная
гистологическая картина при синдроме Бадда-Киари?
Острому синдрому Бадда-Киари
свойственны застойные изменения в центральной части дольки печени и расширение
перивенулярных синусоидов. Возможен некроз гепатоцитов зоны III. Через
4 недели на этом месте развиваются фиброз, а через 4 месяца — регенеративные
узелки и цирроз. При исследовании печеночных вен и нижней полой вены иногда
выявляется концентрическое утолщение их стенок без признаков воспаления.
К нарушению оттока крови от печени приводит как фиброзный процесс под интимой
сосудов, так и организация тромба в его просвете.
8. Каков прогноз у пациентов
с синдромом Бадда-Киари? Каково его лечение?
Лечение пациентов с синдромом
Бадда-Киари во многом зависит от того, каким, острым или хроническим, является
процесс, а также от наличия сопутствующих заболеваний. В случае острого
начала, когда диагноз тромбоза печеночных вен не вызывает сомнений (например
у пациентов с травмой живота или рецидивирующим синдромом Бадда-Киари после
пересадки печени), показана тромболитическая терапия и введение гепарина.
Показатели применения тканевых активаторов плазминогена и стрептокиназы
весьма неубедительны. Первоначально успешные результаты чрес-кожной внутрипросветной
и хирургической ангиопластики сведены на нет большим числом рецидивов.
У пациентов с миелопролиферативными
заболеваниями интенсивное лечение препаратами гидроксимочевины в сочетании
с гепарином обеспечивает благоприятный исход. Хороший эффект дает также
симптоматическая терапия — лапароцентез и назначение диуретиков.
Тем не менее отдаленный
прогноз при синдроме Бадда-Киари достаточно неутешителен, и большинство
пациентов (по данным одного исследования, > 90 %) умирают в течение 3,5
лет. Единственный метод лечения, позволяющий снизить смертность при этом
заболевании,— пересадка печени. Хотя вопрос о данном радикальном методе
остается спорным, трансплантация печени с последующей антикоагулянтной
терапией с успехом применялась во многих лечебных центрах; пятилетняя выживаемость
после операции составляла более 60 %. Однако имеются сообщения, что после
пересадки печени синдром Бадда-Киари рецидивирует у 20 % пациентов. При
невозможности выполнения трансплантации печени производят наложение портокавальных
анастомозов; данная манипуляция сопровождается приблизительно таким же
показателем рецидивов.
9. Что такое облитерирующий
эндофлебит печеночных вен?
Облитерирующий эндофлебит
печеночных вен (веноокклюзионная болезнь печени, болезнь Киари) — это нетромботическая
окклюзия мелких печеночных вен, вызванная разрастанием соединительной ткани
и коллагеновых волокон. Поражения печеночных вен большого диаметра при
этом не происходит. Заболевание характеризуется появлением застойных изменений
в центре печеночной дольки с некрозом гепатоцитов и без такового. Болезнь
Киари может прогрессировать с возникновением экстенсивного перивенулярного
фиброза, образованием соединительно-тканных мостиков между центральными
венулами (мостовидный некроз) и, в конечном счете, формированием цирроза.
10. Каковы причины развития
облитерирующего эндофлебита печеночных вен?
Таковыми могут послужить
употребление в пищу растений, содержащих алкалоиды пирролизидина, химиотерапия
раковой опухоли, пересадка костного мозга, облучение печени, а также лечение
арсфенамином и уретаном. После трансплантации костного мозга заболевание
выявляется у 2-64 % пациентов (показатель зависит от происхождения трансплантата
(аутологичного или аллогенного) и от интенсивности химиотерапии).
11. Когда у больных, перенесших
пересадку костного мозга, следует подозревать развитие облитерирующего
эндофлебита печеночных вен?
Первые признаки и симптомы
облитерирующего эндофлебита печеночных вен могут появиться в течение первой
недели после токсического воздействия, приведшего к нарушению кровообращения
в стенке сосуда. Клиническая картина болезни Киари у пациентов, перенесших
пересадку костного мозга, характеризуется увеличением массы тела и возникновением
асцита в первые две недели после операции. Большинство случаев диагностируются
в течение 1-2 месяцев. К основным симптомам заболевания относятся желтуха,
гепатомегалия, боли в животе и асцит. Трансяремная биопсия печени, выполненная
на этой стадии, способствует ранней диагностике заболевания. При гистологическом
исследовании определяются расширение перивенулярных синусоидов, фиброз,
некроз гепатоцитов зоны III, окклюзия центральных венул и флебосклероз.
12. Какие заболевания
сердца могут стать причиной нарушения функции печени?
Застойные явления в печени
наблюдаются при всех врожденных и приобретенных заболеваниях сердца, вызывающих
развитие сердечной недостаточности. Имеются сообщения о нарушении функции
печени у больных с ишемической болезнью сердца, артериальной гипертонией,
ревматической болезнью сердца, легочным сердцем, врожденными пороками,
констриктивным перикардитом, склеродермией и поздним сифилисом. Основным
патогенетическим механизмом является нарушение насосной функции сердца,
приводящее к стазу крови на уровне печеночных вен.
13. Каковы клинические
проявления застойной печени у пациентов с правожелу-дочковой недостаточностью?
Для пациентов с правожелудочковой
недостаточностью характерны боли в правом подреберье различной интенсивности,
и, иногда, слабо выраженная желтуха. При объективном обследовании могут
выявляться гепатомегалия с печеночно-яремным рефлюксом, асцит и периферические
отеки.
14. Какие биохимические
нарушения обнаруживаются у пациентов с застойной печенью?
При острой сердечной недостаточности
(шоковых состояниях) возможно тяжелое поражение печени. У таких пациентов
отмечается резкое возрастание уровней ACT и АЛТ (обычно уровень АЛТ выше,
чем уровень ACT), удлинение протромбинового времени и постепенное повышение
уровня билирубина. У некоторых больных развиваются необратимые изменения
печени и полная клиническая и биохимическая картина острой печеночной недостаточности.
При хронической сердечной недостаточности уровни ACT и АЛТ увеличены незначительно;
характерны высокие уровни билирубина и щелочной фосфатазы.
15. Опишите гистологическую картину
застойной печени.
При гистологическом исследовании
печеночных биоптатов выявляются застойные изменения в центре печеночной
дольки, характеризующиеся расширением центральных вен и синусоидов и исчезновением
перивенулярных гепатоцитов. У нелеченых пациентов процесс прогрессирует:
появляется перивенулярный фиброз, формируются фиброзные тяжи между центральными
венами и, в конечном счете, развивается цирроз. Следует заметить, что большинство
пациентов умирают от сердечной недостаточности раньше, чем у них возникает
цирроз печени.
16. Какая сосудистая опухоль
печени встречается наиболее часто?
Гемангиома — самая
распространенная сосудистая опухоль печени. По данным аутопсий, она обнаруживается
у 2-5 % населения и одинаково часто поражает мужчин и женщин. Однако у
женщин гемангиома имеет, как правило, большие размеры, что объясняется
пролиферативным эффектом женских половых гормонов. У большинства пациентов
заболевание протекает бессимптомно и не требует лечения. При крупных гемангиомах
возможно развитие диссеминированного внутрисосудистого свертывания крови
(ДВС-синдрома), тромбоцитопении и гипофибриногенемии (синдром Казабаха-Меррита
[Kasabach-Merrit]). Наиболее результативным диагностическим методом является
эмиссионная компьютерная томография одиночных фотонов (SPECT) с использованием
эритроцитов, меченных технецием 99т. Исследование особенно эффективно при
опухолях размером > 2 см. При маленьких гемангиомах применяются магнитно-резонансная
томография и ангиография. Биопсия печени не показана (за исключением тех
случаев, когда она выполняется по другому поводу). Гемангиомы у взрослых
растут значительно медленнее, чем любые другие опухоли. Хирургическое лечение
(резекция печени) рекомендуется пациентам с ДВС-синдромом или кровотечениями.
17. Какова частота развития ангиосаркомы
печени?
Ангиосаркома печени встречается
очень редко (по данным аутопсий, в 1 случае из 50 000). Ею чаще страдают
мужчины в возрасте 60-70 лет. Ангиосаркомы развиваются из эндотелиальных
клеток синусоидов. При гистологическом исследовании выявляются характерные
веретенообразные опухолевые клетки с гиперхроматическими ядрами. Возникновению
опухоли способствует контакт с торотрастом (оксидом тория), винилхлоридом
и соединениями мышьяка. Прогноз при ангиосаркоме неблагоприятный, и большинство
пациентов умирают в течение 6 месяцев после постановки диагноза.
18. Какие сосудистые опухоли печени
синтезируют VIII фактор свертывания крови?
При гистологическом анализе
в таких опухолях определяются два типа клеток: эпителиоидные и дендритные.
Они локализуются в смешанной строме (фиброзной с участками кальцификатов).
Во многих дендритных клетках обнаруживаются характерные вакуоли, позволяющие
поставить правильный диагноз. У большинства больных отмечаются конституциональные
симптомы (45 %), анорексия, повышенная утомляемость и боли в правом подреберье.
Уровень а-фетопротеина при этом обычно нормальный.
Диагноз подтверждается при
компьютерной томографии или биопсии печени. При ангиографии (если таковая
выполняется) выявляется объемное образование печени. Результаты эмиссионной
компьютерной томографии одиночных фотонов (SPECT) с использованием эритроцитов,
меченных технецием 99т, отрицательные. Даже в случае доброкачественного
течения эти опухоли необходимо, по возможности, резецировать. Больным с
неоперабельными опухолями показана пересадка печени. Имеются сообщения
о рецидивировании новообразований после трансплантации.
19. Назовите наиболее распространенные
причины развития тромбоза воротной вены.
Самая частая причина развития
тромбоза воротной вены у детей — инфекционный тромбоз, вызванный омфалитом.
У взрослых тромбоз воротной вены сопутствует таким хроническим заболеваниям,
как портальная гипертензия при циррозе печени; гиперкоагуляция при синдроме
Бадда-Киари; воспалительный процесс (ретроперито-неальные инфекции или
панкреатит) или травматические осложнения, связанные с . проведением врачебных
манипуляций (послеоперационные или постангиографические).
Острая стадия заболевания
характеризуется появлением болей в животе, лихорадки, симптомами кишечной
непроходимости и печеночной недостаточности. В хронической стадии выявляются
асцит, спленомегалия и кровотечения из варикозно расширенных вен пищевода
и желудка. Основной диагностический метод — ангиография воротной вены.
В острой фазе тромбоза вводят гепарин и тромболитики, однако эффективность
данных мероприятий не очень высока. Если тромбоз воротной вены распространяется
на селезеночную или верхнюю брыжеечную вены, трансплантация печени технически
невыполнима, а прогноз — самый неблагоприятный.