 |
|
МЕНЮ
|
Курсовая работа: Качественный анализ неизвестного веществаКомплексоны - неизбирательные реагенты. Селективность комплексонов повышают различными приемами: уменьшением рН среды, выделением (осаждением, экстракцией) определяемого иона, маскированием, изменением степени окисления катиона и т.д. [11]. Практическое применение Высокая устойчивость координационных соединений металлов с Y4- открывает принципиальную возможность титриметрического определения большой группы катионов. Различные способы комплесонометрического титрования могут быть следующим: прямое, обратное, по методу вытеснения и д.р. При прямом титровании к раствору исследуемого иона небольшими порциями добавляют стандартный раствор комплексона. Значение рН при титровании должно быть больше 7. Но это может вызвать выпадение гидроокисей металлов. Для предупреждения применяют аммиачный буфер (для никеля, меди, цинка и кадмия) и еще добавляют тартраты или цитраты (для марганца и свинца). Так как в точке эквивалентности концентрация определяемого иона резко уменьшается, то эту точку нужно фиксировать по изменению окраски индикатора, образующего внутрикомплексное соединение с катионом металла. Индикатор реагирует на изменение показателя концентрации катиона металла рМе аналогично тому, как рН индикатор реагирует на изменение рН. Таким образом, определяют ионы Са, Sr, Ba, Cu, Mg, Mn, Zn и др. До комплексонометрического метода не существовало достаточно надежных методов анализа соединений содержащих эти металлы. Обратное титрование применяют тогда, когда рН, необходимое для образования комплекса, вызывает осаждение определяемого металла, а также при отсутствии надежного индикатора на ион металла. Титрованный раствор ЭДТА добавляют в небольшом избытке к раствору анализируемой соли. Устанавливают, вводя буферный раствор, нужный рН. Избыток ЭДТА оттитровывают раствором хлорида магния или хлорида цинка. Точка эквивалентности фиксируется по изменению окраски индикатора. Обратное титрование применяют также. Когда ион металла взаимодействует с ЭДТА или метало индикатором замедленно, например в случае иона никеля. Этот метод применяют в случае, когда прямое титрование невозможно вследствие образования малорастворимых осадков катионов металлов с присутствующими в растворе анионами, например PbSO4,CaC2O4·2H2O. Осадки в процессе титрования должны раствориться. Титрование путем вытеснения одного катиона другим применяют в том случае, когда не удается подобрать соответствующего индикатора для определяемого иона или же когда катион металла при заданном рН не может быть переведен из осадка в раствор. В этом случае можно соединение с комплексоном получить обменной реакцией при титровании соли определяемого металла раствором соединения какого-либо другого металла с ЭДТА. Например, титруют раствором комплексоната магния или цинка. Для применения этого метода необходимо, чтобы образующееся соединение определяемого металла с комплексоном было прочнее, чем комплексонат магния или цинка[10]. В настоящее время комплексонометрические методики разработаны для анализа очень многих объектов. Определение жесткости воды было первым практически важным применением ЭДТА в аналитической химии. Жесткость воды характеризуют молярной концентрацией эквивалентов кальция и магния. Содержание этих элементов определяют прямым титрованием пробы воды в аммонийном буфере 0,01М раствором ЭДТА в присутствии эриохром черного Т. тяжелые металлы предварительно осаждают в виде сульфидов и маскируют цианидом. Жесткость воды обусловленную содержанием солей кальция, можно определить титрованием пробы с мурексидом в щелочной среде. Комплексонометрическое титрование используют также для анализа различных сплавов, определения сульфатов, фосфатов и других анионов, для анализа органических соединений. Физико-химические методы установления точки эквивалентности в комплексонометрии[3] Различные физико-химические методы обычно используют для установления оптимальных условий титрования. Кроме того, с помощью физико-химических методов можно проводить определения элементов, для которых еще не найдены цветные индикаторы. Потенциометрическое титрование комплексоном выполняют с помощью ионоселективных электродов или используют инертные электроды из благородных металлов, реагирующие на изменения окислительно-восстановительного потенциала системы. С помощью биметаллической пары электродов платина-вольфрам можно титриметрически определить свинец, медь, цинк, никель, кадмий и другие элементы. Широко применяют амперометрическое титрование ЭДТА для определения никеля, цинка, кадмия, свинца. Используют кондуктометрическое, фотометрическое, термометрическое и другие виды титрования комплексоном с физико-химической индикацией точки эквивалентности. 2.3 Расчет кривой титрования методом комплексонометрии Оценить возможность титриметрического определения и построить кривую титрования для следующих данных 0,05М ZnCl2 0,025M Na2H2Y, pH 9, концентрация аммиака 0,1 моль/л. Запишем уравнение титриметрической реакции: Zn2++ H2Y2-→ZnY2-+2H+ Расчет кривой титрования сводится к расчету показательной концентрации Zn2+ в зависимости от объема титранта. Устойчивость ZnY2- зависит от кислотности среды (чем выше кислотность, тем ниже устойчивость), в связи с этим для связывания ионов водорода, количественное определение ZnCl2 проводят в среде аммонийного буфера. Рассчитаем объем титранта по закону эквивалентов:
откуда
Наличие иона Н+ в среде, где присутствует трилон В, приводит к протеканию следующих конкурирующих реакций: Y4-+H+ « HY3-, HY3-+H+ « H2Y2-, H2Y2-+H+
« H3Y-, H3Y-+H+
« H4Y, где K1, K2, K3, K4 – константы ступенчатой диссоциации H4Y (K1=1,0.10-2, K2=2,1.10-3, K3=6,9.10-7, K4=5,5.10-11)[5]. Рассчитаем условную константу устойчивости, которая выражает прочность комплексов цинка с трилоном В:
Рассчитаем коэффициенты конкурирующих реакций:
Zn2+ участвует также в конкурирующих реакциях образования комплексных соединений с аммиаком NH3 в соответствии со следующими уравнениями реакций: n2++NH3 Zn2++2NH3 Zn2++3NH3 Zn2++4NH3
По данным литературного источника[5]
Подставив, выражения (4) и (5) в уравнение константы устойчивости (3) получим:
1) до начала титрования, в отсутствии конкурирующих реакций с участием цинка, концентрация ионов Zn2+ равна концентрации соли ZnCl2 ZnCl2 →Zn2++2Cl- [Zn2+]=C 2)до точки эквивалентности величина pZn определяется концентрацией неоттитрованного иона цинка уравнение (а), так диссоциацией комплексоната, образующегося по уравнению(б) при избытке ионов цинка можно пренебречь. а)Zn2++H2Y2-→ ZnY2-+2H+ б)ZnY2- ↔Zn2++Y4-.
Проведем расчет для точек
3) В точке эквивалентности расчет концентрации ионов Zn2+ проводится с учетом уравнения реакции диссоциации комплекса: ZnY2-↔Zn2++Y4- Данное равновесие количественно описывается константой:
[Zn2+] = [Y4-] = x, [ZnY2-] = [ZnCl2],
[Zn2+] = 1,8 ∙ 10-5 pZn = 4.7 4)после точки эквивалентности концентрация комплексоната металла остается постоянной Концентрация ионов лиганда определяется избытком добавленного титранта:
откуда :
Для найденных значений [Zn2] и [Y4-] вычисляются значения pZn2+ и pY4- и строится кривая титрования в координатах pZn2+- Vтитранта. Проводится анализ кривой титрования, рассчитывается скачок титрования, выбирается индикатор. В таблице 3 представлены данные расчета изменений концентрации ионов определяемого вещества и титранта в зависимости от объема добавляемого титранта (при условии что объем раствора в процессе титрования не изменяется). Таблица 3-Изменение pZn при титровании трилоном Б.
Проанализируем полученную кривую. Как видно, в области точки эквивалентности происходит резкое изменение концентрации ионов цинка, которое можно отметить с помощью соответствующего индикатора. Скачок титрования составляет pZn2+=6.5-3,6=2,9, то есть величину достаточную для фиксирования точки эквивалентности. На основании этого можно сделать вывод о возможности комплексонометрического определения цинка в области заданных концентраций. Индикаторами в комплексонометрии являются металлоидикаторы , образующие с ионами металлов интенсивно окрашенные соединения, константы устойчивости которых, однако, ниже чем константы бесцветных комплексов трилона Б с ионами металлов [3]. Подбор индикатора осуществляется в соответствии с условиями титрования, описанными в справочнике Лурье [5]. Сопоставив условия титрования, представленные в задаче, с данными из справочника [5], приходим к заключению что, в данном случае индикатором является 0,1% водный раствор кислотный хром синий К, обеспечивающий переход окраски из розовой в серо-голубую. 2.4 Определение анионного состава сточных вод В подавляющем большинстве случаев солевой состав природных вод определяется катионами Са2+, Мg2+, Nа+, К+ и анионами НСO3-, Сl- , SO42-. Эти ионы называются главными ионами воды или макрокомпонентами; они определяют химический тип воды. Остальные ионы присутствуют в значительно меньших количествах и называются микрокомпонентами; они не определяют химический тип воды. По преобладающему аниону воды делятся на три класса: гидрокарбонатные, сульфатные и хлоридные. Воды каждого класса делятся, в свою очередь, по преобладающему катиону на три группы: кальциевую, магниевую и натриевую. В природных водах присутствуют также растворенные газы. В основном это газы, которые диффундируют в воды из атмосферы воздуха, такие как кислород, углекислый газ, азот. Но в то же время в подземных водах или водах нецентрализованных источников водоснабжения, в минеральных и термальных водах могут присутствовать сероводород, радиоактивный газ радон, а также инертные и другие газы. Существует несколько методов определения анионного состава воды. Метод комплексонометрического титрования[3] Определение многих анионов основано на осаждении их малорастворимых соединений титрованным раствором какого-либо катиона, избыток которого затем оттитровывается ЭДТА. Сульфат по этой методике осаждают в виде BaSO4 хлоридом бария и последующим комплексонометрическим титрованием избытка ионов Ba2+ по специальной методике. Фосфат осаждают в виде MgNH4PO4 и оставшееся в растворе количество магния определяют комплексонометрически. Хроматография[8] Ионная хроматография – метод качественного и количественного определения ионов в растворах. Он позволяет определять неорганические и органические анионы, катионы щелочных и щелочноземельных металлов, катионы переходных металлов, амины и другие органические соединения в ионной форме. Во всем мире ионная хроматография используется чаще других методов, обеспечивая выявление множества компонентов в любой воде. Для проведения анализов используются ионные хроматографы. Основным элементом любого хроматографа является разделяющая аналитическая колонка. Анализ таких неорганических анионов, как фторид, хлорид, нитрит, нитрат, сульфат и фосфат, методом ионной хроматографии многие годы является самым распространенным во всем мире. Кроме ионохроматографических колонок для определения основных не органических анионов разработаны и успешно применяются высокоэффективные колонки, наряду со стандартными анионами они выявляют и оксианионы такие как оксихалиды: хлорит, хлорат, бромат и др. Аргентометрия.[9] Аргентометрия (от лат. argentum - серебро и греч. metreo - измеряю), титриметрический метод определения анионов (Hal-, CN-, PO43-, CrO42- и др.), образующих малорастворимые соединения или устойчивые комплексы с ионами Ag+ Исследуемый раствор титруют стандартным раствором AgNO3 или избыток последнего, введенный в анализируемый раствор, оттитровывают стандартным раствором NaCl (т. наз. обратное титрование). В методе Мора индикатором служит раствор К2СrО4, образующий с Ag+ при рН 7-10 осадок Ag2CrO4 красного цвета; метод применим для определения хлоридов и бромидов. В методе Фаянса применяют адсорбционные индикаторы ( флуоресцеин, эозин), которые адсорбируются на поверхности осадка, изменяя его цвет. Для определения галогенидов часто применяют метод Фольгарда. В этом случае к исследуемому раствору добавляют избыток раствора AgNO3 Определение гидрокарбонат-ионов[4] При одновременном присутствии в воде ионов HCO3- и CO32- определение ведут в одной пробе, нейтрализуя рабочим раствором соляной кислоты щелочность, создаваемую этими ионами. Щелочностью называют содержание в воде веществ, вступающих в реакцию с сильными кислотами, т.е. с ионами водорода. Расход кислоты выражает общую щелочность. В обычных природных водах щелочность зависит, как правило, только от гидрокарбонат-ионов щелочноземельных металлов. В этом случае значение рН воды не превышает 8,3. Общая щелочность практически тождественна карбонатной жесткости и соответствует содержанию гидрокарбонатов. Карбонат ионы содержаться в щелочных водах. Обычно питьевая вода не содержит карбонатов. На это указывает отсутствие розовой окраски от прибавления к пробе фенолфталеина. В этом случае в воде определяют только гидрокарбонаты титрованием кислотой в присутствии метилоранжа. Определение нитритов[6] Присутствие в незагрязненных поверхностных водах нитритных ионов связано главным образом с процессами минерализации органических веществ и нитрификации. Аммонийные ионы под действием особого вида бактерий окисляются до нитритных ионов: NH4+ + OH - + 2/3O2 = H + + NO2- + 2 H2O В поверхностных водах нитритный азот находится главным образом в виде нитритных ионов. В кислых водах может присутствовать некоторое количество HNO2. Нитриты не обладают сильно выраженной способностью к комплексообразованию. Реакция взаимодействия диазонитрованной в присутствии нитритов сульфаниловой кислоты с ароматическими аминами является одной из самых чувствительных реакций, с помощью которых могут быть обнаружены очень малые (единицы мкг/л) количества нитритных ионов. Нитритные ионы - неустойчивые вещества, определение которых должно производиться вскоре после отбора. Пробы предварительно фильтруют через мембранный фильтр 0,45 мкм. Если анализ не может быть выполнен немедленно, пробу консервируют добавление 2-4 мл хлороформа на 1 л воды и хранят при температуре 3-5о С в течение 1-3 суток. Заключение 1.Курсовая работа включает пояснительную записку, изложенную на 38 страницах, содержащую 3 таблицы и графическую часть на формате А1, содержащую блок-схему идентификации неизвестного вещества и кривую титрования. 2.Изучены основные приемы и методы качественного и количественного анализа. В соответствии с ними произведен анализ выданного образца. Показано, что анализируемый образец представляет собой смесь двух солей Pb(NO3)2 и (CH3COO)2Pb. 3.Рассмотрены методы титриметрического анализа. Более подробно рассмотрен метод комплексонометрического титрования. Произведен расчет и построение кривой титрования методом комплексонометрического титрования -0,05 M ZnCl2 0.025M Na2H2Y, рН 9,С(NH3)=0.1 моль/л. Аналитическая характеристика кривой титрования: показано, что кривая титрования имеет явный перегиб вблизи точки эквивалентности, что дает основание на возможность применения данного метода анализа (для заданных условий). Точка эквивалентности соответствует значению рZn = 4.7. В области точки эквивалентности происходит резкое изменение концентрации ионов Zn2+, которое можно отметить с помощью соответствующего индикатора (кислотный хром синий К). Список использованных источников информации 1.Алексеев В.Н. Качественный химический полумикроанализ. M.: Химия. 1973. 2.Воскресенский А.Г , Солодкин И.С. практическое руководство по качественному полумкроанализу.1972-133с. 3. Васильев В.П. Аналитическая химия: В 2 кн.: Кн.1: Титриметрические и гравиметрические методы анализа: Учеб. для студ. вузов, обучающихся по химико-технол. спец.- 4-е изд., стереотип.- М.: Дрофа, 2004. – 368с.:ил. 4. Кольтгоф И. М., Сендэл Е. Б., Количественный анализ, пер. с англ., 3 изд., М.-Л., 1948, с. 496 5.Лурье Ю.Ю. Справочник по аналитической химии.- М.: Химия, 1979. – 480с. 6. Семенов А.Д, М.М. Евстифеев, Ю.М. Гаврилко. Методические указания к практикуму “Анализ объектов окружающей среды” Определение биогенных элементов в природных водах . г. Ростов-на-Дону -2001-17c 7. Сильченко Л.А., Пашаян А.А. Аналитическая химия и физико-химические методы анализа. Методические указания по выполнению курсовой работы для студентов II курса специальности 330200”Инженерная защита окружающей среды”(часть II) – Брянск, БГИТА, 2005.- 58с. 8. Рабинович В.А., Хавин З.Я. "Краткий химический справочник" Л.: Химия, 1977 стр. 95 9. Рыбакова Е.В. Ионная хроматография –современный метод анализа всех типов вод/ Е.В. Рыбакова// Экология и промышленность России.- 2000.- №13.- с.34-36 10.Шемякин Ф.М. аналитическая химия. Изд.3-е, испр. и доп. Учебник для фармацевтических вузов. М., «Высш.школа». 1973 11. Шварценбах Г, Флашка Г., Комплексонометрическое титрование, пер. с нем. |
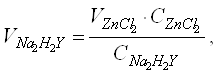 (2)
(2)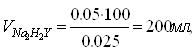
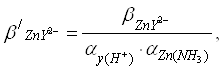 (3)
(3)  (4)
(4)
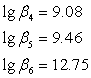

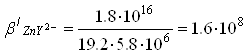
 (7)
(7) ,
,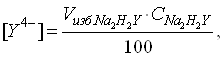 (8)
(8) (9)
(9) 