|
|
МЕНЮ
|
Курсовая работа: Исследование системы гемостаза при экстракорпоральном оплодотворенииСинтез ряда наиболее важных факторов свертывания (факторов V, VII, X, IX и II), а также двух основных физиологических антикоагулянов - протеинов С и S - осуществляется паренхиматозными клетками печени - гепатоцитами, причем для того, чтобы они могли участвовать в процессе свертывания крови, все эти факторы, кроме фактора V, должны подвергнуться γ-карбоксилированию витамин-К-зависимой карбоксилазой. Поэтому при дефиците витамина К и нарушении его всасывания из кишечника (при кишечном дисбактериозе, обтурации общего желчного протока), а также под влиянием непрямых антикоагулянтов (кумаринов, фенилина), являющихся функциональными антагонистами витамина К, нарушается синтез всех витамин К-зависимых факторов свертывания, а также протеинов С и S, вследствие чего может возникнуть тяжелая кровоточивость, сочетающаяся в некоторых случаях с микротромбированием сосудов и некрозами тканей из-за недостатка антикоагулянта - протеина С. Такое же нарушение свертываемости крови наблюдается и при тяжелых заболеваниях печени, но при этом снижается уровень в крови не только всех витамин К-зависимых факторов свертывания, но и фактора V, а также альбумина. Различают три этапа процесса свертывания крови Первый этап завершается активацией фактора X в так называемом протромбиназном комплексе, в состав которого входят, наряду с фактором X, фактор V, ионы кальция и фосфолипидные матрицы. Активация факторов в этом комплексе может осуществляться двумя путями: внешним и внутренним. Запуск внешнего реализуется поступлением из тканей в кровь тканевого тромбопластина (или тканевого фактора - ТФ). Свертывание по этому механизму, который в пробирке имитируется добавлением к плазме тканевого тромбопластина, обозначается как протромбиновый (тромбопластиновый) тест. Коагуляция в нем происходит очень быстро, в течение 12-15 с. Другим механизмом запуска процесса свертывания крови является внутренний путь. Он связан с контактом крови с субэндотелием (коллагеном), а также с разрушенными эритроцитами (при внутрисосудистом гемолизе), а в пробирке - с контактом со стеклом. При этом механизме последовательно активируются в комплексах «фактор XII (фактор Хагемана) + прекалликреин + фактор XI», а затем «фактор XI + фактор IX + фактор VIII», после чего процесс, как и в предыдущем механизме, замыкается на активации фактора X с образованием протромбиназного комплекса. Внутренний механизм первого этапа свертывания протекает намного медленнее, чем внешний. Он определяется общим временем свертывания крови, временем рекальцификации цитратной плазмы и активированным парциальным тромбопластиновым временем (АПТВ). В отличие от пробирочных опытов в организме оба указанных выше механизма свертывания крови не строго изолированы друг от друга, а взаимодействуют между собой. Второй этап свертывания крови заключается в активации протромбиназным комплексом (т. е. фактором Ха в комплексе с фактором Va + Ca2+ + фосфолипидная матрица) протромбина, который, расщепляясь, превращается в активный тромбин (фактор IIa). Таким образом, второй этап процесса свертывания завершается образованием активного тромбина. На третьем этапе процесса этот активный тромбин отщепляет от α- и β -цепей фибриногена два пептида А и два пептида В, в результате чего в плазме крови повышается содержание этих пептидов и одновременно - мономеров фибрина (МФ) с четырьмя свободными связями. Вслед за этим начинается процесс полимеризации МФ - образование их димеров, затем тетрамеров и, в конечном счете - волокон и сгустков фибрина. гемостаз бесплодие экстракорпоральный оплодотворение 1.5.1 Протромбиновое время Протромбиновое время (синоним время Квика) - показатель интенсивности процессов свертывания крови на стадии превращения протромбина в тромбин, представляющий собой продолжительность (в секундах) образования сгустка исследуемой плазмы крови в присутствии тромбопластина и солей кальция. ПВ - скрининг-тест для определения факторов (фибриногена, протромбина, факторов V, VII и X), участвующих в свертывании крови, инициированном высокой концентрацией тканевого фактора. 1.5.2 Активированное частичное тромбопластиновое время Скрининг-тест для определения факторов (фибриногена, протромбина, факторов V, VIII,IX, X, XI, XII, прекалликреина и высокомолекулярного кининогена), участвующих в свертывании крови при контактной активации. Скрининговый фосфолипидзависимый тест, дающий представление о нарушениях, связанных с эффектом волчаночного антикоагулянта – ВА. 1.5.3 Тромбиновое время Тромбиновое время - показатель активности антитромбинов крови; определяется по продолжительности свертывания исследуемой плазмы (до образования сгустка) после добавления к ней стандартного раствора тромбина. ТВ - скрининг-тест последней стадии свертывания крови – реакции между тромбином и фибриногеном – антикоагулянтной активности антитромбина III 1.5.4 Фибриноген Фибриноген – гликопротеид с молекулярной массой около 340000 дальтон. Молекула фибриногена представляет собой димер, каждая единица которого содержит три полипептидные цепи –α (А), β (В) и γ с молекулярной массой соответственно 67000, 58000 и 47000 дальтон. Общая формула молекулы фибриногена: (α(А), β(В) γ)2. целостность этой молекулы во многом определяется дисульфидными связями. Фактор I в том виде, в каком он вырабатывается паренхиматозными клетками печени и поступает в кровь, получил название фибриногена А. Под действием тромбина фибриноген превращается в нерастворимый в крови фибрин, составляющий основу тромба. 1.6 Противосвертывающие механизмы и система фибринолиза В свертывающей системе крови действуют силы как аутокатализа, или самоускорения, так и самоторможения, в силу чего многие факторы свертывания крови и их фрагменты приобретают свойства антикоагулянтов. В частности, сам фибрин и продукты расщепления фибриногена плазмином обладают противосвертывающим действием. Однако наиболее важны для поддержания крови в жидком состоянии так называемые первичные, т. е. самостоятельно синтезируемые и постоянно находящиеся в крови, антикоагулянты (табл. 2). Таблица 2. Основные первичные антикоагулянты
Помимо перечисленных в табл. 2 важнейших физиологических антикоагулянтов, в патологических условиях в крови могут появляться в высоком титре иммунные ингибиторы факторов свертывания крови - антитела к факторам VIII, IX и другим, а также к фосфолипидным матрицам, на которых взаимодействуют и активируются факторы свертывания крови (антифофолипидный синдром). Фибринолитическая (плазминовая) система, как и система свертывания крови, активируется как по внешнему, так и по внутреннему механизму. Наиболее мощным внешним активатором этой системы является продуцируемый в эндотелии, а также в ряде тканей тканевый плазминогеновый активатор (ТПА), на долю которого приходится около 70% всего активаторного эффекта. Еще около 15% внешнего механизма активации приходится на фермент урокиназу, который вырабатывается в почках и в наибольшей своей части выделяется с мочой, а в кровь попадает в значительно меньшем количестве. На остальные активаторы, поступающие в кровь извне, приходится лишь небольшая часть указанной активности, но в патологических условиях она может быть резко усилена тканевыми и лейкоцитарными протеазами, бактериальными активаторами (стрептокиназой, стафилокиназой и др.) и другими экзогенными протеолитическими ферментами (протеазами змеиных ядов и др.). Внутренний механизм активации фибринолиза осуществляется в основном комплексом «фактор XIIа+калликреин+высокомолекулярный кининоген» (так называемый XIIа - калликреин зависимый фибринолиз), активированными протеинами C+S. Механизмы активации фибринолиза замыкаются на плазминогене, который трансформируется в активный фермент – плазмин (в прошлом он обозначался как фибринолизин). Плазминоген и его активаторы фиксируются в основном на сгустках фибрина в тромбах, в связи с чем лизис фибрина преобладает над лизисом растворенного в плазме фибриногена. Кроме того, действию плазмина на фибриноген препятствует содержащийся в плазме мощный ингибитор этого фермента – а2-антиплазмин. Однако при чрезвычайно сильной активации плазминогена происходит истощение а2-антиплазмина, и в плазме крови обнаруживается большое количество продуктов как фибринолиза, так и фибриногенолиза. Эти продукты не идентичны друг другу. В результате расщепления фибриногена в плазме нарастает количество конечного продукта этого процесса - фрагмента D, тогда как при расщеплении фибрина увеличивается концентрация фрагментов D-D (димера) и D-E-D. Путем раздельного определения концентрации в плазме фрагментов D и D-димеров можно получить представление, в какой степени у больного активированы фибринолиз и фибриногенолиз. Более того, при проведении таких анализов учитывается, что для нарастания в крови продуктов фибринолиза, т. е. D-димера, должно раньше произойти свертывание крови - образование фибрина, а затем его расщепление до фрагмента D-D. Поэтому увеличение концентрации в плазме D-димера служит ценным показателем как интенсивного внутрисосудистого свертывания крови, так и сопряженного с этим процессом фибринолиза. Такое нарастание содержания в крови D-димера является важным маркером массивного тромбоза кровеносных сосудов, тромбоэмболии, диссеминированного внутрисосудистого свертывания крови. 1.6.1 Антитромбин III Антитромбин III (АТ III) является а2-глобулином с молекулярной массой около 64000. Синтезируется в печени. Выполняет роль основного плазменного кофактора гепарина, под влиянием которого трансформируется из прогрессивного антикоагулянта в ингибитор немедленного действия. Инактивирует тромбин, факторы ХIIа, XIa, Ха, IXa, калликреин и фибринолизин. 1.6.2 Протеин С Физиологический антикоагулянт, в активированном состоянии инактивирует активные V, VII факторы, ингибирует активатор плазминогена (активность проявляется преимущественно в микроциркуляторном русле). Активность протеина С кратковременно увеличивалась к 5-7 дню стимуляции, что связано с действием половых гормонов. В нашем городе активность протеина С не определяется. 1.7 Осложнения У определенного процента женщин в ходе реализации программы ЭКО и ПЭ возникает такое осложнение, как СГЯ (синдром гиперстимуляции яичников). По выраженности симптомов и уровню половых гормонов СГЯ подразделяют на легкую, среднюю и тяжелую формы. Распространенность умеренных и тяжелых форм СГЯ составляет от 1 до 10%. Тяжелые проявления сопровождаются кровотечением, асцитом, гидротораксом, нарушением баланса электролитов, печеночно-почечной недостаточностью, тромбоэмболией и поэтому рассматриваются, как один из основных рисков при реализации программы ЭКО и ПЭ. Была выявлена прямая зависимость между тяжестью течения СГЯ и выраженностью изменений, свидетельствующих об активации во всех звеньях системы гемостаза. У пациенток с риском развития СГЯ рекомендуется проводить исследования системы гемостаза несколько раз в период с момента переноса эмбрионов до дня первичной диагностической беременности с целью своевременного назначения противотромботической терапии и контроля за ее проведением. 2. Материалы и методы исследования 2.1 Материалы исследованияДля исследования системы гемостаза были обследованы 10 пациенток в возрасте 26 – 33 лет на всех основных этапах реализации программы ЭКО и ПЭ (стимуляция, день введения ХГ, день ПЭ, 14-й день после ПЭ). Показатели гемостаза исследовали в плазме крови. Сосудисто-тромбоцитарный гемостаз оценивали по количеству тромбоцитов. Для подсчета тромбоцитов использовали агрегометр АР 2110. Для оценки изменений прокоагулянтной активности плазмы крови определяли ПВ, АПТВ, ТВ и концентрацию фибриногена на гемокоагулометре CGL 2110. Антикоагулянтное звено гемостаза оценивали с помощью определения активности АТ III на гемокоагулометре CGL 2110. Необходимо отметить, что на 14 день после переноса эмбрионов у пациенток проводили определение β-ХГ для выяснения вопроса о наступлении беременности (эффективности программы). В ходе обследования десяти пациенток был получен следующий результат: у семи женщин наступила беременность (эффективный цикл); у трех женщин – отсутствие беременности (неэффективный цикл). 2.2 Методы исследования сосудисто – тромбоцитарного гемостаза 2.2.1 Определение количества тромбоцитов Состав набора: адреналин; растворитель для адреналина, 8,5 мл – во флаконе. Оборудование, материалы, реагенты: пипетки вместимостью 0,05 – 2,0 мл; физиологический (0,9%) раствор хлорида натрия. Приготовление анализируемых образцов: венозную кровь центрифугируют при 1000 об/мин (240 g) в течение 7 мин. Богатую тромбоцитами плазму переносят в другую пробирку и повторно центрифугируют при 3000 об/мин (1200g) в течение 15 мин., в результате получают бедную тромбоцитами плазму. Разведение адреналина: во флакон с адреналином внести 8,0 мл растворителя для адреналина и развести содержимое при комнатной температуре путем встряхивания в течение 10 мин. В результате получают маточный раствор адреналина (500 мкг/мл). Для приготовления рабочего раствора адреналина из маточного пользуются следующей схемой:
Запись агретограмм проводят в соответствии с инструкцией к агрегометру. С помощью растворов адреналина разной концентрации получают запись кривых агрегации тромбоцитов. Наряду с кривыми агрегации на экране отображается количество тромбоцитов в исследуемой плазме. В норме количество тромбоцитов составляет 140 – 400*109/л 2.3 Методы исследования коагуляционного гемостаза 2.3.1 Определение протромбинового времени (Техпластин – тест) Принцип метода: тромбопластин (фактор III, тромбокиназа) превращает протромбин плазмы крови в присутствии ионов кальция в активный фермент тромбин, трансформирующий фибриноген плазмы крови в нерастворимый фибрин. Измеряется протромбиновое время – время образования фибрина в плазме крови в присутствии ионов кальция и тканевого тромбопластина (растворимого экстракта из мозга человека). Состав набора: техпластин – лиофильно высушенная тромбопластин-кальциевая смесь, на 5,0 мл суспензии – 4 фл. МИЧ Техпластина в разных сериях составляет 1.1 или 1.2.; контрольная плазма – лиофильно высушенный пул плазмы крови не менее, чем от 20 здоровых людей, на 0,5 мл – 1фл. Оборудование, материалы, реагенты: коагулометр; пипетки вместимостью 0,1; 0,2; 0,5; 5,0 мл; вода дистиллированная. Приготовление анализируемых образцов: венозную кровь центрифугируют при 3000 – 4000 об/мин (1200 g) в течение 15 мин. Получают бедную тромбоцитами плазму. Подготовка реагентов к работе: Разведение Техпластина: в один флакон с Техпластином внести 5,0 мл дистиллированной воды. Флакон встряхнуть и выдержать при +370С в течение 20 мин. Разведение контрольной плазмы: во флакон с контрольной плазмой внести 0,5 мл дистиллированной воды и растворить содержимое при комнатной температуре и легком покачивании в течение 3 мин. Разведенную плазму перед исследованием выдержать 25-30 мин. при комнатной температуре. Проведение анализа: Определение контрольных (нормальных) показателей: 1. В кювету коагулометра внести 0,1 мл контрольной плазмы. 2. Инкубировать при температуре + 370С 1 мин. 3. Добавить 0,2 мл разведенного Техпластина, имеющего температуру +370С и начать отсчет времени свертывания до образования фибрина. Аналогично определить протромбиновое время в образцах плазмы больных. В норме протромбиновое время, измеренное на коагулометре, составляет 12-15 с. Рассчитывают протромбиновый индекс по следующей формуле: ПТИ = (ПВ контрольной нормальной плазмы /ПВ больного) x 100%В норме ПТИ составляет 85 – 105%. 2.3.2 Методы определения АЧТВ ((АПТВ/АЧТВ) – тест) Принцип метода: определяется время свертывания плазмы крови в условиях стандартизированной контактной (каолином) и фосфолипидной (кефалином) активации процесса в присутствии ионов кальция. Состав набора: кефалин (лиофильно высушенный фосфолипидный компонент) – 2 фл.; каолин (концентрированная суспензия 200:1 в дистиллированной воде), 1 мл – 1 фл.; буфер трис НСl (концентрированный 20:1 раствор, 1 М), 10 мл – 1 фл.; кальция хлорид (концентрированный 20:1 раствор, 5 М), 10 мл – 1 фл. Оборудование, материалы, реагенты: коагулометр; пипетки вместимостью 0,1; 5,0 мл; вода дистиллированная; цилиндр мерный вместимостью 200 мл. Приготовление анализируемых образцов: венозную кровь центрифугируют при 1000 об/мин (240 g) в течение 7 мин. Богатую тромбоцитами плазму переносят в другую пробирку и повторно центрифугируют при 3000 об/мин (1200g) в течение 15 мин., в результате получают бедную тромбоцитами плазму. Подготовка реагентов к работе: Разведение кефалина: в один флакон с кефалином внести 2,0 мл дистиллированной воды и растворить содержимое при комнатной температуре и энергичном покачивании в течение 2 мин. В результате получают раствор кефалина, который до использования должен быть выдержан при комнатной температуре в течение 60 мин. Приготовление АПТВ – реагента: концентрированный буфер трис НСl и концентрированную суспензию каолина количественно перенести из флаконов в мерный цилиндр и общий объем довести дистиллированной водой до 200 мл. В результате получают рабочую суспензию каолина. Для приготовления AЧТВ - реагента смешать в пробирке 0,1 мл раствора кефалина с 3,0 мл рабочей суспензии каолина. Приготовление рабочего раствора хлорида кальция: в день исследования, в соответствии с потребностью, концентрированный раствор хлорида кальция развести дистиллированной водой в 20 раз (1 объем концентрированного раствора + 19 объемов воды). Проведение анализа: 1. В кювету коагулометра внести 0,1 мл исследуемой плазмы и прогреть ее при +370С в течение 1 мин. 2. В кювету добавить 0,1 мл AЧТВ - peaгeнтa, имеющего комнатную температуру. 3. Через 3 мин к смеси добавить 0,1 мл рабочего раствора хлорида кальция и зарегистрировать время свертывания. AЧТВ в нормальной плазме составляет 28-38 с. 2.3.3 Определение тромбинового времени (Тромбо – тест) Принцип метода: заключается в определении времени свертывания плазмы крови под влиянием тромбина стандартной активности. Состав набора: тромбин (лиофильно высушенный, 6-8 ед NIH во фл.) - 4 фл.; контрольная плазма (лиофильно высушенная) - 1 фл. Оборудование, материалы, реагенты: коагулометр; пипетки вместимостью 0,1 - 1,0, 10,0 мл; вода дистиллированная; Приготовление анализируемых образцов: венозную кровь центрифугируют при 3000 – 4000 об/мин (1200 g) в течение 15 мин. получают бедную тромбоцитами плазму. Подготовка реагентов к работе: Разведение тромбина: в один из флаконов с тромбином внести необходимое количество дистиллированной воды (см. таблицу) и растворить содержимое при комнатной температуре и легком покачивании в течение 2-3 мин. Ориентировочные значения нормы тромбинового времени свертывания
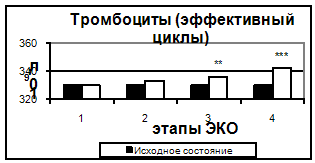
Разведение контрольной плазмы: во флакон с контрольной плазмой внести 0,5 мл дистиллированной воды и растворить содержимое при комнатной температуре и легком покачивании в течение 3 мин. Проведение анализа: 1. В кювету коагулометра внести 0,1 мл контрольной плазмы и прогреть ее при +370С в течение 1 мин. 2. В ту же кювету добавить 0,1 мл раствора тромбина и зарегистрировать время свертывания. Исследование плазмы больного выполняется аналогично. Чтение результатов: результат выражают в секундах, сравнивают время свертывания контрольной и исследуемой плазмы. В норме ТВ составляет 14 – 17 с. 2.3.4 Определения концентрации фибриногена (Квик – Фг – тест) Принцип метода: образовавшийся после свёртывания плазмы крови фибрин быстро высушивается и по его весу определяется содержание фибриногена в плазме. Состав набора: тромбопластин, 1 г – 2 фл.; хлорид кальция (концентрированный 20:1 раствор, 5,54%), 10 мл – 6 фл.; буфер трис – НСl (концентрированный 20:1 раствор, 1 М), 10 мл – 2 фл. Оборудование, материалы, реагенты: термобаня на 370; весы торсионные; центрифуга лабораторная; пробирки стеклянные; цилиндр мерный вместимостью 200 мл; ступка фарфоровая с пестиком; вода дистиллированная; бумага фильтровальная. Приготовление анализируемых образцов: кровь центрифугируют при 3000 – 4000 об/мин (1200g) в течение 15 мин. Получают бедную тромбоцитами плазму. Приготовление реагентов: Приготовление суспензии тромбопластина: навеску сухого тромбопластина (50 мг) поместить в фарфоровую ступку, добавить 1,0 мл физиологического (0,9 %) раствора хлорида натрия или раствора трис – буфера (0,05 М, pH 7,4) и тщательно растирать в течение 2 мин. Затем дополнительно добавить в ступку 4,0 мл выбранного раствора, перемешать с помощью пестика и взвесь центрифугировать при 1000 об/мин (240 g) в течение 5-6 мин. Надосадочную жидкость слить в другую пробирку и использовать для анализа. Разведение концентрированного буфера: содержимое одного флакона с концентрированным буфером трис – НСl перенести в мерный цилиндр и довести объем дистиллированной водой до 200 мл. Получаем рабочий раствор буфера. Проведение анализа: 1. В пробирке последовательно смешать 1,0 мл исследуемой бедной тромбоцитами плазмы крови, 0,1 мл суспензии тромбопластина и 0,1 мл 5, 54 % раствора хлорида кальция. 2. Пробирку встряхнуть и поместить на водяную баню при +37оС на 10 мин. 3. Образовавшийся в результате инкубации сгусток перенести на фильтровальную бумагу и высушивают путём сжатия и перемещения сгустка по фильтру. 4. Сгусток фибрина выдержать на открытом воздухе при комнатной температуре в течение 15 – 20 мин и взвесить на торсионных весах. В норме масса сгустка, полученного из 1 мл плазмы крови, составляет 10 – 20 мг. Содержание фибриногена в г/л находят при умножении массы сухого фибрина на коэффициент 0,2. В норме содержание фибриногена в плазме составляет 2,0 – 4,0 г/л. 2.4 Методы исследования антикоагулянтного гемостаза 2.4.1 Определение активности антитромбина III Принцип метода: исследуемую плазму обрабатывают сорбентом гепарина, подвергают тепловой дефибрикации и смешивают со стандартным количеством тромбина. После инкубации смеси в ней определяют остаточную коагуляционную активность тромбина. По уровню снижения активности тромбина оценивают активность АТ III в исследуемой плазме. Оборудование и материалы: коагулометр; набор реагентов для определения активности антитромбина III ООО Технология – Стандарт. Проведение анализа: в пробирку вносят 0,4 мл раствора тромбина и прогревают на водяной бане (37оС) в течение 2 мин. Параллельно в кювету коагулометра вводят 0,15 мл разведённой плазмы (или раствора фибриногена) и инкубируют при t 37оС не менее 1 мин. К раствору тромбина в пробирку добавляют 0,1 мл исследуемой адсорбированной и дефибринированной плазмы, включают секундомер. Через 2 минуты (точно!) инкубируют при той же температуре 0,1 мл смеси, вносят в кювету коагулометра, содержащую разведённую контрольную плазму и начинают отсчёт времени свёртывания. По калибровочной кривой, построенной с применением коагулометра, определяют активность АТ III в процентах. В норме активность АТ III составляет 80 – 120%. 3. Результаты и их обсуждение3.1 Исследование сосудисто–тромбоцитарного гемостазаРезультаты исследования сосудисто – тромбоцитарного гемостаза представлены на рис. 1. Общее количество тромбоцитов не менялось на протяжении всей стимуляции, достоверно увеличиваясь только к 14 дню после переноса эмбрионов.
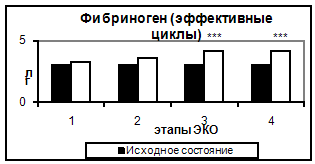
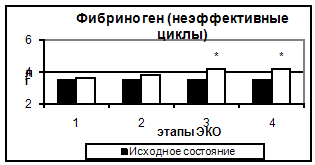
Рис. 1. Количество тромбоцитов в эффективных и неэффективных циклах. Здесь и на рис. 2-6 1- стимуляция суперовуляции, 2- день введения хорионического гонадотропина, 3- день переноса эмбриона в полость матки, 4- 14–ый день после переноса эмбриона. Достоверность отличий: 3.2 Исследование коагуляционного гемостаза Результаты исследования коагуляционного гемостаза представлены на рис. 2-5. Концентрация фибриногена постепенно возрастала, начиная с 5-7 дня стимуляции до дня ПЭ, и сохранялась на уровне в 1,4 раза превосходящем исходный до 14 дня после ПЭ.
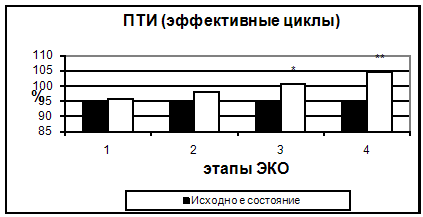
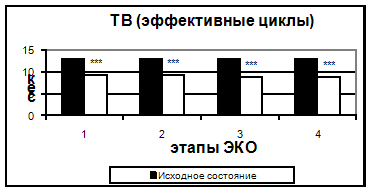
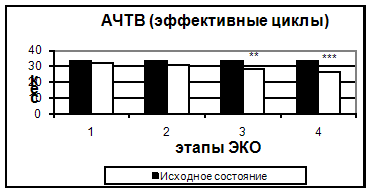
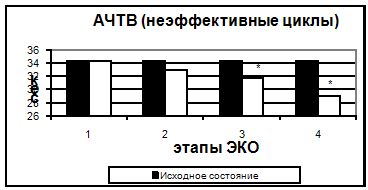
Рис. 2. Протромбиновый индекс в эффективных и неэффективных циклах. Также, начиная с 5-7 дня стимуляции, было отмечено достоверное укорочение тромбинового времени. Увеличение протромбинового индекса и укорочение АЧТВ, свидетельствующие о повышении активности факторов внешнего и внутреннего пути свертывания, происходило только к 14 дню. Можно предположить, что полученные изменения являются результатом длительного воздействия высоких концентраций половых гормонов.
Рис. 3. АЧТВ в эффективных и неэффективных циклах.
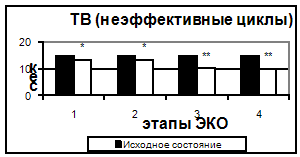
Рис 4. Тромбиновое время в эффективных и неэффективных циклах.
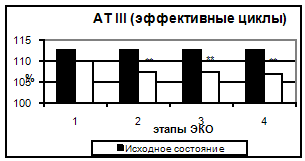
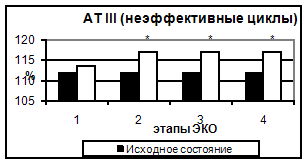
Рис. 5. Концентрация фибриногена в эффективных и неэффективных циклах. Таким образом, в результате проведения стимуляции суперовуляции происходит усиление коагуляционного потенциала крови за счет увеличения концентрации основного субстрата свертывания крови – фибриногена и повышения суммарной активности факторов, составляющих как внешний, так и внутренний путь активации гемостаза. 3.2 Исследование антикоагулянтного звена гемостаза Результаты исследования антикоагуляционного гемостаза представлены на рис. 6. АТ III практически не изменялся на всем протяжении исследования. Отмечалось лишь достоверное снижение активности АТ III (на 5,1%) ко дню введения овуляторной дозы ХГ (пик стимуляции и уровня эстрадиола).
Рис. 6. АТ III в эффективных и неэффективных циклах. На фоне наступившей беременности и высокого уровня половых гормонов поддерживаются более значимые изменения гемостазиологических показателей, что может неблагоприятно влиять на развивающуюся беременность. При увеличении коагулятивной активности крови можно наблюдать нарушение (снижение) кровотока в матке, что затрудняет нормальное развитие эмбриона. По-видимому, у пациенток с наступившей беременностью в циклах ЭКО и ПЭ на 14 день после переноса эмбрионов развивается состояние, потенциально опасное для развития тромботических осложнений и ДВС-синдрома. Тем не менее, и в случае отсутствия беременности при ЭКО и ПЭ большинство параметров значительно отличались от исходного уровня. Выводы В результате исследования были отмечены следующие изменения в системе гемостаза: 1. Усиление прокоагулянтных свойств сосудистого эндотелия, 2. Наиболее выраженные изменения претерпевают такие лабораторные параметры гемостаза, как: а. повышение уровня фибриногена, б. укорочение тромбинового времени. 3. У данных больных развитие беременности сопряжено с повышенным риском. |
Страницы: 1, 2