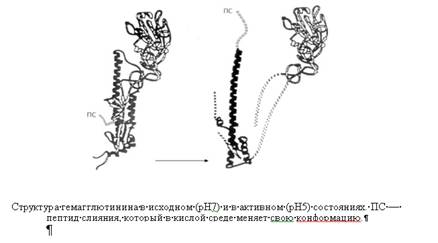
|
|
МЕНЮ
|
Курсовая работа: Механизмы проникновения вирусов в клетку. Биохимические и цитофизиологические аспектыКурсовая работа: Механизмы проникновения вирусов в клетку. Биохимические и цитофизиологические аспектыМЕХАНИЗМЫ ПРОНИКНОВЕНИЯ ВИРУСОВ В КЛЕТКУ. БИОХИМИЧЕСКИЕ И ЦИТОФИЗИОЛОГИЧЕСКИЕ АСПЕКТЫ. Введение Вирусные инфекции составляют многочисленную группу инфекционных заболеваний, возбудители которой относятся к единственным известным в настоящее время неклеточным формам жизни, паразитирующим на молекулярно-генетическом уровне клетки. Внеклеточно вирион биологически инертен и не способен к репродукции и индукции обменных процессов. После проникновения в клетку вирус начинает функционировать как самостоятельная генетическая единица. Таким образом, основные события вирусного инфицирования макроорганизма происходят на клеточном уровне, и изучение закономерностей течения инфекции в клетке позволяет понять механизмы развития патологического процесса в целом. Известно, что вирусы млекопитающих проникают в клетки, используя их рецепторы, но только в последнее десятилетие начались исследования молекулярных механизмов поэтапного проникновения этих инфекционных агентов. Данный процесс определяет последующую транспортировку вирусной геномной информации к сайтам ее считывания и репродукции в клетке-хозяине. На настоящий момент термином "вход" обозначается четыре этапа инициации жизненного цикла вирусов в клетках-мишенях. К первому этапу относится присоединение вирионов к рецепторам клеточной мембраны, при котором происходят первоначальные конформационные изменения белков наружной оболочки вирусов. Ко второму, - взаимодействие с корецепторами посредниками проникновения вируса в клетку. Этот процесс сопровождается дальнейшими конформационными изменениями белковых компонентов вирусной оболочки, а также изменениями клеточной плазмалеммы. Третьим этапом является непосредственное перемещение вируса в клеточной мембране, обозначаемое термином проникновение или "penetration" и осуществляемое с помощью различных механизмов. К заключительному - четвертому, этапу входа относится освобождение генома вируса от нуклеокапсидной оболочки и начало транскрипции его РНК. На третьем этапе входа вирусов в клетку необходимо остановиться, поскольку именно в последние годы были сделаны определенные открытия, связанные с возможностью использования новых методов исследования, позволяющих изучать молекулярную основу различных процессов в живых клетках. Так, ранее относительно механизмов входа вируса в клетку было принято, что отдельный или несколько гетерогенных вирионов могут проникать в клетку различными способами, такими как: микрофагоцитозом - виропексисом, локальным нарушением целостности клеточной плазмалеммы, а также путем прямого слияния с нею оболочки вируса. По данным современной литературы различают 6 способов проникновения вирусов в клетки: макропиноцитоз, три вида эндоцитоза (клатрин-зависимый, клатрин-независимый и холестерол-зависимый), с помощью образования кавеол (вогнутости плазматической мембраны) и подобный последнему механизм, зависимый от динамина. Как известно, взаимодействие вируса и клетки может происходить двумя путями: неспецифическим (инициируется при случайном столкновении, когда вирионы удерживаются на клеточной поверхности за счет электростатических сил) и специфическим (осуществляется при наличии на клеточной поверхности рецепторов, обеспечивающих прочное прикрепление вируса к клетке). После адгезии вирус проникает через плазмалемму и затем происходит перемещение его генома к определенным участкам цитоплазмы и ядра клетки, где инициируется процесс репродукции. 1. Присоединение вирионов к рецепторам клеточной мембраны Как клеточные, так и вирусные рецепторы относятся к специфическим структурам и комплементарны друг другу. Определение специфичности этапа адгезии чрезвычайно важно, так как именно в начальной стадии вирусного инфицирования определяются клетки-хозяева и проявляется тропизм вирусов к определенным типам тканей. Природа клеточных рецепторов крайне разнообразна, и их функция тесно связана со структурой клеточной поверхности. По химическому составу все рецепторы клеток подразделяются на две группы: 1) содержащие липиды - липопротеиновые рецепторы; 2) содержащие углеводы - мукопротеиновые рецепторы. Несмотря на существующее многообразие поверхностных вирусных белков, определяющих антигенную специфичность, различные типы вирусов для присоединения к клеткам могут использовать одинаковые клеточные рецепторы, при этом известно, что на липопротеиновых рецепторах избирательно адсорбируются миксовирусы и аденовирусы, тогда как арбовирусы и энтеровирусы на мукопротеиновых. Для выявления и идентификации клеточных рецепторов, специфичных для вирусов, используются различные методы исследования, например, биохимические, когда клеточные рецепторы прицельно могут быть разрушены определенными ферментами. С помощью последних было установлено, что группа вирусов, таких как короновирусы, вирусы гриппа А, В и С, способны связываться с ацетилнейроаминными кислотами. Наибольшая группа специфичных для вирусов рецепторов определена путем использования моноклональных антител, иммобилизированных на аффинном геле, а также метода рекомбинантной ДНК технологии. Так, для аденовирусов рецепторами являются интегрины групп α и β, сульфатированные протеогликаны, для вирусов гепатита - олигомерные лектины, для флавивирусов - глюкозаминогликаны (CD81 и др.), Fс γ и гепаран сульфат протеогликаны. Существенно, что некоторые вирусы для прикрепления к клеткам могут использовать более чем один рецептор, как было обнаружено для вирусов комплекса герпеса, или с одним и тем же рецептором одномоментно могут связываться два вируса. Так, известен факт конкуренции аденовирусов и вируса Коксаки В за рецептор суперсемейства иммуноглобулинов - CAR. 2. Взаимодействие с корецепторами, приводящее к конформации составляющих элементов вирусной оболочки и изменениям клеточной плазмалеммы инфекционный вирус клетка При распространении в организме и переходе из одной клеточной популяции в другую может наблюдаться мутация белков вирусной оболочки. Подобные изменения выявлены для вируса иммунодефицита человека, у которого происходит преобразования гликопротеинов оболочки из структуры 120 в 41, что позволяет помимо первичного рецептора также связываться с макрофагальными или, дендритными клетками слизистой оболочки через рецептор CCR5 и с Т-клетками через CXCR4. Определено, что рецептор полиовируса для его связывания с поверхностью клеток представляет собой вершину пятигранной осевой структуры, состоящей из копий одного и того же белка, и находится в углублении (каньоне). Размер каньона меньше, чем размеры иммуноглобулинов клетки. При этом отмечается высокий консерватизм участков подобных белков для всех представителей семейства пикорнавирусов. Поэтому клеточными рецепторами для этих вирусов являются различные интегрины (а2 β3, аv β1, аv β6 и др.), β-микроглобулины и иммуноглобулины (CD54, CD55, CAR). На примере вируса гриппа, который относится к группе вирусов с наличием липопротеиновой оболочки - суперкапсида, разработана общая концепция "загруженного прыжка" от стабильного состояния к конформационным изменениям поверхностной структуры вириона, при низких значениях рН. В составе суперкапсида этого вируса содержится гемагглютинин-нейраминидазный белок, включающий компонентный протеин М2, активируемый при низком значении рН как проводящий избирательный канал для протонов. Изменение концентрации протонов нарушает электростатическое взаимодействие между рибонуклеопротеинами вириона и его основным компонентом гемагглютинин- нейраминидазного белка М1. Это приводит к освобождению вириона от оболочки в эндосоме.
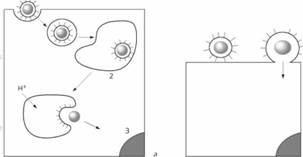
Подобные белкам слияния вируса гриппа обнаружены протеины у вируса парагриппа 5F, у вируса иммунодефицита человека (НIV) - гликопротеин 41 (gp41), у вируса лейкемии мышей - групповой трансмембранный белок и у вируса Эбола - гликопротеин 2 (gp2). Несмотря на структурное отличие, белок Е вируса клещевого энцефалита по своим свойствам подобен белкам слияния, описанным выше, и относится к их второй группе. Низкое значение рН индуцирует перегруппировку олигомеров суперкапсида этого вируса, когда субъединицы нативного гомодимера Е диссоциируют в мономерные субъединицы, после чего происходит формирование гомотримера. Таким образом, после рН индуцированной диссоциации димера, связь с плазмалеммой клеток опосредуется мономерной формой белка Е. Помимо показателя рН, для присоединения вируса клещевого энцефалита и альфавирусов к клеткам определенное значение имеет также наличие холестерола, который в большом количестве присутствует в составе плазмалеммы. Несмотря на то, что взаимодействие вируса с рецепторами клетки необходимо для инициации инфекции, ее патогенез является процессом, состоящим из множества этапов. Поэтому развитие болезни находится в зависимости от ряда причин, а именно: от внутриклеточной способности противостоять инфекции, связанной со способностью клеток инициировать развитие иммунного ответа; от скорости размножения вируса в клетках и тканях; от цитопатогенности и распространения инфекции внутри и между органами. Причем при условии, что инфекция не прогрессирует, вирус-рецептор-опосредованный сигнал может вызывать секрецию цитокинов и других биологически активных веществ, оказывающих влияние на развитие болезни. Например, вирусы иммунодефицита человека и простого герпеса через маннозный рецептор индуцируют наработку моноцитами и дендритными клетками интерферона α. Как уже упоминалось выше, вирусы, несмотря на их принадлежность к различным семействам, могут связываться с одними и теми же рецепторами клеток. Так, с гепарансульфатным протеогликаном, присутствующим на поверхности моноцитов/макрофагов, могут связаться вирусы герпеса, иммунодефицита человека, цитомегаловирус, аденовирусы второй группы, флавивирус Денге и другие. Возможно, что этот рецептор помогает вирусам прикрепляться к клеточной поверхности и, в дальнейшем, содействует их проникновению, что было показано на модели флавивирусов Денге и клещевого энцефалита. После первоначального связывания с гепарансульфатным протеогликаном, эти вирусы присоединяются к аффинным ему (специфичным) рецепторам, которые индуцируют эндоцитоз и последующее слияние вирусного суперкапсида с плазмалеммой клетки. Помимо отмеченного свойства различных вирусов присоединяться к одному типу рецептора, выявлена способность одного и того же вируса связываться с различными рецепторами. Так, аденовирусы присоединяются к рецепторам иммуноглобулинового семейства и интегринам (аv β3 и аv β5), вирус кори - к рецепторам CD46 и вирус Коксаки - к β2 - микроглобулинам и аv β3 -интегринам. В процессе проникновения в клетку последнего вируса, относящегося к группе вирусов без наличия суперкапсида - "неодетым", его нуклеокапсид икосаэдрального типа претерпевает конформационные изменения. Посредством каньонов на поверхности вируса, которые образуются в результате таких преобразований, происходит его связывание с рецептором клетки, общим для аденовирусов и вируса Коксаки - CAR (Coxsackie virus-adenovirus receptor), являющимся трансмембранным протеином иммуноглобулинового семейства с двумя внеклеточными доменами молекулярной массой 46 кДа. Интересно, что некоторые штаммы вируса Коксаки В могут использовать для присоединения также рецептор CD55 (рецептор для фактора, усиливающего разрушение - decay-accelerating factor, DAF), который необходим как корецептор семейства интегринов для успешного входа этих вирусов в клетки. Полиовирус, который также относится к "неодетым" вирусам, связывается со специфическим для него рецептором, названным полиовирусным (hPVR, CD155). Этот рецептор принадлежит к семейству рецепторов, содержащих иммуноглобулиновые внеклеточные домены и экспрессируется в четырех объединенных вариантах α, β, γ и σ. Места, посредством которых этот вирус связывается с клеточными рецепторами, находятся в каньонах нуклеокапсида. У человека, белки полиовирусного рецептора экспрессированы на многих клетках и тканях, включая тонкий кишечник, легкие, печень, сердце, нейроны и мышцы. Указывается, что чувствительность к поливирусной инфекции положительных по наличию этого рецептора мононуклеарных клеток крови может играть важную роль в инвазии вируса в центральную нервную систему. Полиовирусный рецептор также может использоваться для присоединения и других вирусов; таких как, например, вируса α герпеса. В свою очередь, разрушение рецептора либо подавление его функциональной активности приводит к нарушению или даже прекращению адсорбции вируса; что представляет интерес для исследователей, занимающихся вопросами разработки различных фармакологических препаратов. 3. Непосредственное перемещение вируса в клеточной мембране После адгезии вируса на поверхности клетки начинается процесс перемещения его генома и сопутствующих белков через клеточную мембрану в цитоплазму. Исторически сложилось представление о двух альтернативных механизмах проникновения в клетку вирусов животных — путем виропексиса (эндоцитоза) и путем слияния вирусной и клеточной мембран. Однако оба эти механизма не исключают, а дополняют друг друга. Термин «виропексис», предложенный в 1948 г. Фазекасом де сан Гро, означает, что вирусная частица попадает в цитоплазму в результате инвагинации участка плазматической мембраны и образования вакуоли, которая содержит вирусную частицу. Рецепторный эндоцитоз. Виропексис представляет собой частный случай рецепторного или адсорбционного эндоцитоза. Этот процесс является обычным механизмом, благодаря которому в клетку поступают питательные и регуляторные белки, гормоны, липопротеины и другие вещества из внеклеточной жидкости. Рецепторный эндоцитоз происходит в специализированных участках плазматической мембраны, где имеются специальные ямки, покрытые со стороны цитоплазмы особым белком с большой молекулярной массой — клатрином. На дне ямки располагаются специфические рецепторы. Ямки обеспечивают быструю инвагинацию и образование покрытых клатрином внутриклеточных вакуолей. Полупериод проникновения вещества внутрь клетки по этому механизму не превышает 10 мин с момента адсорбции. Количество образующихся в одну минуту вакуолей достигает более 2000. Таким образом, рецепторный эндоцитоз представляет собой хорошо слаженный механизм, который обеспечивает быстрое проникновение в клетку чужеродных веществ. Покрытые вакуоли сливаются с другими, более крупными цитоплазматическими вакуолями, образуя рецептосомы, содержащие рецепторы, но не содержащие клатрин, а те в свою очередь сливаются с лизосомами. Таким путем проникшие в клетку белки обычно транспортируются в лизосомы, где происходит их распад на аминокислоты; они могут и миновать лизосомы, и накапливаться в других участках клетки в недеградированной форме. Альтернативой рецепторного эндоцитоза является жидкостный эндоцитоз (пиноцитоз), когда инвагинация происходит не в специализированных участках мембраны. Большинство вирусов животных (с суперкапсидом и без него) проникает в клетку по механизму рецепторного эндоцитоза. Эндоцитоз обеспечивает внутриклеточный транспорт вирусной частицы в составе эндоцитарной вакуоли, поскольку вакуоль может двигаться в любом направлении и сливаться с клеточными мембранами (включая ядерную мембрану), освобождая вирусную частицу в соответствующих внутриклеточных участках. Таким путем, например, ядерные вирусы попадают в ядро, а реовирусы — в лизосомы. Однако проникшие в клетку вирусные частицы находятся в составе вакуоли и отделены от цитоплазмы ее стенками. Им предстоит пройти ряд этапов, прежде чем они смогут вызвать инфекционный процесс. Слияние вирусной и клеточной мембран. Для того чтобы внутренний компонент вируса мог пройти через клеточную мембрану, вирус использует механизм слияния мембран. У вирусов, имеющих суперкапсид, слияние обусловлено точечным взаимодействием вирусного белка слияния с липидами клеточной мембраны, в результате которого вирусная липопротеидная оболочка интегрирует с клеточной мембраной, а внутренний компонент вируса оказывается по другую ее сторону. У вирусов, не имеющих суперкапсид, один из поверхностных белков также взаимодействует с липидами клеточных мембран, в результате чего внутренний компонент проходит через мембрану. Большинство вирусов животных выходит в цитозоль из рецептосомы. Если при эндоцитозе вирусная частица является «пассивным пассажиром», то при слиянии она становится активным участником процесса. Белком слияния является один из ее поверхностных белков (о них было упомянуто выше). Общая схема проникновения вирусов с суперкапсидом в клетку:
Слева — эндоцитоз и слияние в эндосоме: 1 — вирус, 2 — эндосома, 3 — ядро; справа— слияние с плазматической мембраной. С позиций современной вирусной цитопатологии, классификация механизмов проникновения вирусов через плaзматическую мембрану пересмотрена в соответствии с открытием новых порталов для попадания питательных веществ в клетку. На данный момент выделяют пять регулируемых порталов: фагоцитоз, пиноцитоз, подразделяемый на макропиноцитоз и различные типы эндоцитоза - клатрин-опосредованный (размер образованной вакуоли ~120 нм), кавеолин-опосредованный (~60 нм), кавеолин- и клатрин-независимый эндоцитоз (~90 нм). Для вирусов присущи все вышеозначенные пути проникновения, поэтому необходимо более точное описание указанных порталов. · Фагоцитоз у млекопитающих характерен для специализированных клеток моноцитов, макрофагов и нейтрофилов - и в этот процесс вовлекаются специфические рецепторы и последующий сигнальный каскад опосредуется определенными семействами ферментов - гуанинтрифосфатаз (ГТФазы). Данные ферменты играют ключевую роль для классификации порталов питательных веществ в клетки млекопитающих. Это большая группа ферментов, которые участвуют в связывании гуанинтрифосфатов и подвергаются конформационным изменениям при гидролизе гуанинтрифосфата в гуаниндифосфат в присутствии ионов Mg2+. Наибольший интерес представляет семейство мономерных ГТФаз сигнальной каскадной трансдукции и движения (signal transduction cascades and motility, Ras), которые по химической структуре подразделяют на девять групп: Rho (А, В, С изоформы фермента), Rac (1, 2, 3 изоформы), Rab, Cdc42 (G25K, Cdc42Hs изоформы), RhoD, RhoG, TC10, Rnd (Rndl, RhoE/Rnd3, Rnd6) иTTF. Причем каждая группа участвует в определенных функциях клетки. Так, при фагоцитозе активируется Rhо-грyппа ГТФаз, связанная с актиновыми структурами цитоскелета, а ее инициация происходит при стимуляции рецепторов плазмалеммы. Rab-грyппа участвует в перемещении уже сформированных везикул в цитоплазме клеток. Таким образом, при фагоцитозе необходима стимуляция рецепторов клетки, после чего активируется Rhо-группа ГТФаз, приводящая в движение актиновые структуры цитоскелета. · В сигнальный каскадный макропиноцитоз также вовлекается Rhо-группа ГТФаз, которая запускает актин-зависимое формирование выступов мембраны. В отличие от фагоцитоза выступы плазмалеммы не соединяются по принципу "молнии" с лигандами поверхности поглощенной частицы, а формируют большую эндоцитарную вакуоль. Мембрана этой вакуоли не связана с поверхностью поглощаемых частиц. · Кавеолин-опосредованный эндоцитоз характеризуется образованием кавеол, которые формируются на специфичных участках плазмалеммы, где сконцентрированы разнообразные сигнальные молекулы, а также молекулы, ответственные за транспорт в плазмалемме клеток. Формирование этих структур связано с определенными липидными участками плазмалеммы в жидкой фазе, обогащенными холестеролом и ориентированными во внутрь мембраны сфингомиелинами и гликосфинголипидами. После интеграции белка кавеолина 1 с этим участком плазмалеммы, происходит инвагинация последней в форме небольшой фляжки, которая называется кавеолой. Кавеолин 1 - это мономер, который при стимуляции собирается в дискретный гомо-олигомер, включающий 14-16 кавеолиновых молекул. Смежные гомо-олигомеры упаковываются в пределах мембраны кавеолы, тем самым, обеспечивая структурную сеть для ее дальнейшего формирования. Причем поглощенный материал химически связан с рецепторами мембраны клетки. Страницы: 1, 2 |
Copyright © 2012 г.
При использовании материалов - ссылка на сайт обязательна.